
题目列表(包括答案和解析)
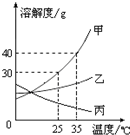 甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图所示,请回答:
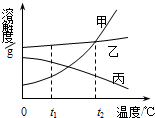 甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法中不正确的是( )
甲、乙、丙三种固体物质的溶解度曲线如图所示,下列说法中不正确的是( )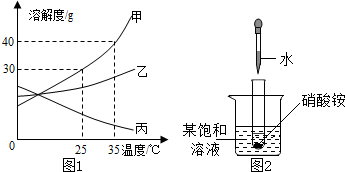 甲、乙、丙三种固体物质的溶解度曲线如图1所示,请回答:
甲、乙、丙三种固体物质的溶解度曲线如图1所示,请回答: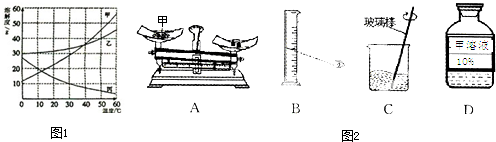
一.单项选择题(每小题3分,共36分)
1. D 2. C 3.D 4.A 5.B 6.C 7.C 8.C 9.C 10.B 11.D 12.D
二.不定项选择题(每小题4分,共12分。每小题有一个或两个选项符合题意,全部选对的得4分,漏选得2分,错选不选得0分。)
13.BC 14. B 15.CD
三.填空简答题(共35分)
16.(6分,每空1分) (1) ①C ②A ③D ④B (2) ①CO2 ②CH4
17.(每空1分共3分)足够的热量; 化学; 有机物;
18.(每空1分共7分)(1)碱 C (2)过滤(专有名词,出现错别字不得分)
(3)活性炭(写“活性碳”、“木炭”不得分)(4)稀盐酸(或“盐酸”、“氯化氢溶液”、“氯化钙溶液”、“氯化钡溶液”等,写“硫酸”、“HCl” 、“HCl溶液”不得分) (5)工业废水处理达标后才能排放(或“基地内生活污水不要任意排放”等科学合理即可、写“农药、化肥不要滥用”不得分)
19.(每空1分共6分)(1)19.00(写“
20.(8分,每空2分) 丙 乙 相等 降温结晶
21.(方程式2分,共5分)(1)氢气 乙>甲>丙(或“乙、甲、丙”,写
“丙<甲<乙”不得分)(2分) (2)Ca(OH)2 +H2SO4= CaSO4 + 2H2O (未配平扣一分)
四.实验探究题(共24分)
22.(共8分)(1)B:集气瓶,H:酒精灯 (2)2H2O2 2H2O+O2↑;(2分) G;
2H2O+O2↑;(2分) G;
(3)水或细沙
(4)AC(填对一个给1分,有错不给分,共2分)
23.(每空1分,共6分) (1)盐 (2)澄清石灰水 澄清石灰水变浑浊(写“有白色沉淀生成”、“有沉淀生成”均可得分) (3)快 一片研碎的药片
【拓展探究】对身体无害(或“安全无毒”等均可得分)
24.(每空2分共10分)(1)气密性(2)B;(3)2Al+6HCl=2AlCl3+3H2↑;不能;因为该反应会放出气体,无论该反应是不是放出热量,导管口都会有气泡冒出。
五.计算题(共13分)
25.(每空2分共6分)
(1)27(2)72∶5 (3)72
26.(共7分)(1)(每空2分) = Na2SO4(2)(3分) 12%
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com