
题目列表(包括答案和解析)
1g氢气燃烧生成液态水,放出142.9KJ热量,下列表示该反应的热化学方程式正确的是
[ ]
A.H2(g)+![]() O2(g)
O2(g)![]() H2O(l) △H=-285.8kJ/mol
H2O(l) △H=-285.8kJ/mol
B.2H2(g)+O2(g)![]() 2H2O(l) △H=-142.9kJ/mol
2H2O(l) △H=-142.9kJ/mol
C.2H2+O2![]() H2O △H=-571.6kJ/mol
H2O △H=-571.6kJ/mol
D.2H2(g)+O2(g)![]() 2H2O(l) △H=+571.6kJ/mol
2H2O(l) △H=+571.6kJ/mol
1g氢气燃烧生成液态水,放出142.9kJ热量,下列表示该反应的热化学方程式正确的是
[ ]
A.2H2(g)+O2(g)=2H2O(l);ΔH=-142.9kJ·mol-1
B.H2(g)+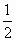 O2(g)=H2O(l);ΔH=-285.8kJ·mol-1
O2(g)=H2O(l);ΔH=-285.8kJ·mol-1
C.2H2(g)+O2=2H2O(l);ΔH=-571.6kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l);ΔH=+571.6kJ·mol-1
1g氢气燃烧生成液态水放出142.9kJ热量,下列表示该反应的热化学方程式正确的是
A. 2H2(g)+O2(g)=2H2O(l) △H=-142.9kJ/mol
B. H2(g)+1/2O2(g)=H2O(l) △H=-285.8kJ/mol
C. 2H2(g)+O2=2H2O(l) △H=-571.6kJ/mol
D. 2H2(g)+O2(g)=2H2O(l) △H=+571.6kJ/mol
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
| ||
| ||
| ||
| CuO/ZnO |
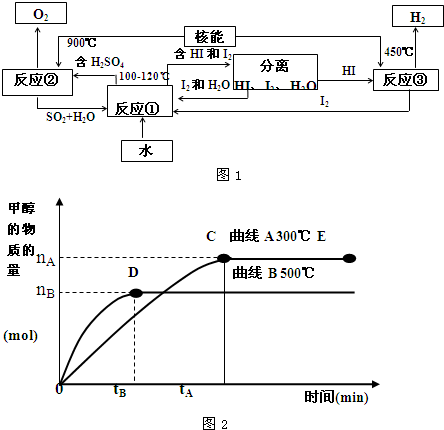
| 1 |
| 2 |
| c(CH3OH) |
| c(CO) |
(15分)科学家认为,氢气是一种高效而无污染的理想能源,近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。
(1)为了有效发展民用氢能源,首先必须制得廉价的氢气,下列可供开发又较经济且资源可持续利用的制氢气的方法是 。(选填字母)
| A.电解水 | B.锌和稀硫酸反应 |
| C.光解海水 | D.分解天然气 |

 CH3OH(g);ΔH =-90.8 kJ·mol-1
CH3OH(g);ΔH =-90.8 kJ·mol-1 CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1
CH3OCH3(g) + H2O(g);ΔH=-23.5 kJ·mol-1 CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1
CO2(g) + H2(g);ΔH=-41.3 kJ·mol-1 CH3OCH3(g) + CO2 (g)的ΔH=
CH3OCH3(g) + CO2 (g)的ΔH= 
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com