
题目列表(包括答案和解析)
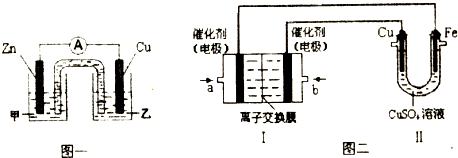
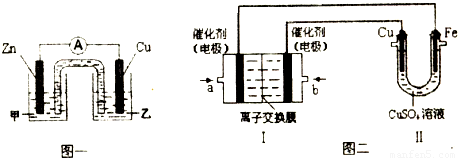
 CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。
CO2↑+CO↑+H2O有人利用这个反应产生的CO还原某种铁的氧化物,并设计了如下图所示的装置。其中A和F中各盛有浓H2SO4,B中盛有乙二酸(H2C2O4),D中盛有NaOH浓溶液,E和I中各盛有澄清石灰水,H中装有铁的氧化物粉末。

Ⅰ.(1)D装置的作用是________。
(2)E装置的作用是________。
(3)I装置的作用是________。
Ⅱ.甲同学用上述装置,取不同质量的铁的氧化物进行实验。所得实验数据如下:
|
实验序号 |
铁的氧化物质量/g |
生成铁的质量/g |
|
1 |
4.00 |
2.81 |
|
2 |
8.00 |
7.62 |
|
3 |
10.00 |
7.01 |
|
4 |
12.00 |
8.42 |
|
5 |
14.00 |
9.81 |
|
6 |
16.00 |
12.22 |
|
7 |
18.00 |
12.63 |
|
8 |
20.00 |
14.03 |
(1)如果以y轴表示生成铁的质量,x轴表示铁的氧化物质量,请用铅笔在上面坐标图上依次找出相应的实验数据的点。

(2)从坐标图上可以看出甲进行第二次实验时,所得数据不十分可靠,故舍去。请分析造成此种结果的原因主要可能是________或________。
(3)请利用上图回答。第二次实验时生成的铁的质量约为________g(小数点后保留一位)。
(4)如果另一位同学乙取了25 g铁的氧化物样品而来不及做实验,但根据上述图示,可以求出所生成的铁的重量为________(小数点后保留一位)。将你所用方法在上图中画出。
(5)同学丙看了甲、乙两同学所做的方法后认为:只要认真进行两次实验,就以回答上述问题。请用甲同学的两组实验数据,用数学方法写出丙同学的分析过程。
(6)丁同学看了上述分析过程后,认为只要一组准确的实验数据就能解决问题。他是怎样分析的?Si+O2=SiO2
(W2-W1)g×
| ||||
| a g |
(W2-W1)g×
| ||||
| a g |
有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。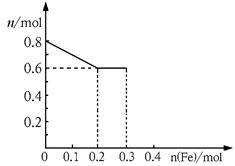
14
15
16
17
18
19
20
21
BC
A
C
D
C
CD
AC
C
三.实验题答案:
22.(一) (1)将小木块从斜板上A点由静止释放,运动至水平板上B点静止;
(2)用图钉把细线拉紧固定在A,B两点间;
(3)用量角器测量细线与水平板间的夹角θ;
(4)动摩擦因数表示为μ=tanθ
(二) (1) 
(2) U/、U分别为V/、V的读数
U/、U分别为V/、V的读数
四.计算题答案:
25(20分). (1)
 ∴
∴ (6分)
(6分)
(2) (6分)
(6分)
(3)∵ ∴
∴ (2分)
(2分)
 (6分)
(6分)
23(16分). (1)单摆的周期 =2s (2分)
=2s (2分)
N次全振动的时间 t=NT= =20s (2分)
=20s (2分)
木箱在这段时间内的位移 S=vt =NTv= =
=
(2)绳子对铁球的拉力 T=mg/cos37° (2分)
球受到的合力 F1=mgtan37° (l分)
根据牛顿定律,球的加速度a=F1/m=gtan37°球相对箱静止,箱的加速度也为此值 (2分)
绳对箱的拉力的竖直向下分力Ty=Tcos37°=mg (2分)
箱子在竖直方向的合力为0,故地面对箱的支持力N=(M+m) g (1分)
绳对箱的拉力的水平向左的分力Tx=Tsin37°=mgtan37° (1分)
设推力大小为 F.则箱受到的合力∑F=F-Tx-μN =Ma,得
F=Ma+TX+μN=(M+m)(μ+tan37°)g=51N (1分)
(用整体法求出推力大小同样给分)
24(18分). (1)当A在B上滑动时,A与BC整体发生作用,由于水平面光滑,A与BC组成的系统动量守恒, ,(2分) 得
,(2分) 得 (1分)
(1分)
系统动能的减小量等于滑动过程中产生的内能,  ,(1分)
,(1分) ,(2分)
得
,(2分)
得 (1分)
(1分)
(2)当A滑上C,B与C分离,A与C发生作用,设到达最高点时速度相等为V2,由于水平面光滑,A与C组成的系统动量守恒,  ,(2分)得
,(2分)得
A与C组成的系统机械能守恒, (2分)
(2分)
得 (1分)
(1分)
(3)当A滑下C时,设A的速度为VA,C的速度为VC,A与C组成的系统动量守恒, , (2分)
, (2分)
A与C组成的系统动能守恒, (2分)
(2分)
得VC =  (2分)
(2分)
 化学答案DDACDBBC
化学答案DDACDBBC
26.(1)
C
N
O
Al
Cl
K
Fe
(2)
(3)(写出其中2个即给分,如多写了B等元素,不给分也不扣分)
|