
题目列表(包括答案和解析)
| ||
硫酸工业在国民经济中占有极其重要的地位。请回答硫酸工业中的如下问题:
(1)若从下列四个城市中选择一处新建一座硫酸厂,你认为厂址宜选在 郊
区(填标号);
| A.有丰富黄铁矿资源的城市 | B.风光秀丽的旅游城市 |
| C.消耗硫酸甚多的工业城市 | D.人口稠密的文化、商业中心城市 |
 SO3 △H <0,现将0.050mol SO2和0.030mol O2
SO3 △H <0,现将0.050mol SO2和0.030mol O2| 沸腾炉温度/℃ | 600 | 620 | 640 | 660 |
| 炉渣中CuSO4的质量分数/% | 9.3 | 9.2 | 9.0 | 8.4 |
硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
| A.矿石加入沸腾炉之前先粉碎 |
| B.使用V2O5作催化剂 |
| C.转化器中使用适宜的温度 |
| D.净化后的炉气中要有过量的空气 |
 O2(g)
O2(g) 2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。硫酸工业在国民经济中占有极其重要的地位。
(1)硫酸的最大消费渠道是化肥工业,用硫酸制造的常见化肥有________(任写一种)。
(2)硫酸生产中,根据化学平衡原理来确定的条件或措施有________(填写序号)。
A.矿石加入沸腾炉之前先粉碎
B.使用V2O5作催化剂
C.转化器中使用适宜的温度
D.净化后的炉气中要有过量的空气
E.催化氧化在常压下进行
F.吸收塔中用98.3%的浓硫酸吸收SO3
(3)在硫酸工业中,通过下列反应使二氧化硫转化为三氧化硫:2SO2(g)+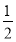 O2(g)
O2(g)  2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
2SO3(g) ΔH=-98.3 kJ·mol-1。在实际工业生产中,常采用“二转二吸法”,即将第一次转化生成的SO2分离后,将未转化的SO2进行二次转化,假若两次SO2的转化率均为95%,则最终SO2的转化率为________。
(4)硫酸的工业制法过程涉及三个主要的化学反应及相应的设备(沸腾炉、转化器、吸收塔)。
①三个设备分别使反应物之间或冷热气体之间进行“对流”。请简单描述吸收塔中反应物之间是怎样对流的。______________________________。
②工业生产中常用氨-酸法进行尾气脱硫,以达到消除污染、废物利用的目的。用化学方程式表示其反应原理。(只写出2个方程式即可)
________________________________________________________________________
硫酸工业在国民经济中占有极其重要的地位.请回答硫酸工业中的如下问题:
(1)早期生产硫酸以黄铁矿为原料,目前很多国家都已经限制以黄铁矿为原料而以硫磺为原料,以硫磺为原料的优点是______.
(2)工业上生产硫酸时,利用催化氧化反应将SO2转化为SO3由一个关键步骤.压强及温度对SO2转化率的影响如下表(原料气各成分的体积分数为:SO27%;O211%;N282)利用表中数据分析,在实际生产中选择的适宜生产条件是:
温度______℃,压强______MPa.
| 压强/Mpa 转化率/% 温度/℃ | 0.1 | 0.5 | 1 | 10 |
| 400 | 99.2 | 99.6 | 99.7 | 99.9 |
| 500 | 93.5 | 96.9 | 97.8 | 99.3 |
| 600 | 73.7 | 85.8 | 89.5 | 96.4 |
(3)选择适宜的催化剂,是否可以提高SO2的转化率?______(填“是”或“否”),是否可以增大该反应所放出的热量?______(填“是”或“否”).
(4)为提高SO3吸收率,实际生产中通常用______吸收SO3.
(5)在催化反应室中设有热交换装置,以下叙述与热交换装置的作用有关的是______(填写序号)
A.保护环境,防止空气污染
B.充分利用热量,降低生产成本
C.升高温度,提高SO2的转化率
D.防止催化剂中毒
(6)在硫酸工业尾气中,SO2是主要大气污染物,必须进行净化处理,处理方法可用______(填名称)吸收,然后再用硫酸处理,重新生成SO2和一种生产水泥的辅料,写出这两步反应的化学方程式______.
一、选择题:(每题6分)
题号
1
2
3
4
5
答案
D
B
C
C
A
二、简答题:(每空2分)
30.(22分)
(1)C、D
(2)无细胞结构 www.ks5 u.com基因的编码区是连续不间隔的
(3)高等植物细胞 具有细胞壁、大液泡,无中心体
(4)具有分裂能力,是未成熟植物细胞 固定→解离→漂洗→染色→制片
(5)①观察细胞质的流动 ②质壁分离及其复原实验
(6)核酸 体液免疫和细胞免疫
31.(20分)
(1)核糖体 线粒体
(2)同化作用大于异化作用
(3)②等量的 标记的胸腺嘧啶脱氧核苷酸和药物X
标记的胸腺嘧啶脱氧核苷酸和药物X
③A组的放射性强度大于B组
(4)原癌基因 糖蛋白
(5)动物细胞培养
(6)①人脾细胞与骨髓廊细胞的融合,人脾细胞与人脾细胞的融合,骨髓瘤细胞与骨髓瘤细胞的融合,未融合的人脾细胞和骨髓瘤细胞
②既具有抗原免疫的人脾细胞分泌特异性抗体的特点,又具有骨髓瘤细胞在体外培养条件下无限增值的能力。
昆明一中2009届高三年级第三次月考
理科综合能力测试?化学参考答案

26.(1)双氧水的电子式;(2)离子键,离子;(3) ;
;
(4) (条件:光照)
(条件:光照)
27.(1)水解反应,中和反应;(2)甲酸甲酯的结构简式,a―羟基乙醛的结构简式;
(3)邻羟基苯甲酸钠的结构简式;www.ks5 u.com (4)略;(5)略(注意:反应物之一为2mol邻羟基苯甲酸钠;产物之一为2mol NaCl);(6)邻甲基苯酚的结构简式,邻甲基乙酸苯酯的结构简式(注:A为邻羧基乙酸苯酯)
28.(1)①非极性,是 ②
③
(2)① ②
②
(3)
29.I。(1)制造化肥、农药、医药、染料、炸药化学纤维等;白油炼制、冶金、机械制造、纺织印染等;
(2)常压下,sO。的平衡转化率已经很高,而且加压对设备的要求更高,增大投资和能源消耗。
Ⅱ。(1)
(2)①通过控制气泡产生的速率从而控制 和
和 的体积比;②吸收
的体积比;②吸收 和
和 中的
中的
 ;
;
(3)化学反应速率不断加快, 和
和 的平衡转化率不断降低;
的平衡转化率不断降低;
(4) b; 极易与
极易与 反应从而引起倒吸。
反应从而引起倒吸。
昆明一中2009届高三年级第三次月考
理科综合能力测试?物理参考答案
题号
14
15
16
17
18
19
20
21
答案
A
BC
BC
B
C
ABC
BC
C
22、(1) 20.65 13.873或13.874
22、(2)① ②
② ,纸带与限位孔之间的摩擦力(或纸带与其他部分的阻力或摩擦阻力)(每空3分)
,纸带与限位孔之间的摩擦力(或纸带与其他部分的阻力或摩擦阻力)(每空3分)
23、解:(1)对小物受力分析,由牛顿运动定律得:  (4分)
(4分)
 (4分)
(4分)
解得: (1分)
(1分)
(2) (3分)
(3分)
 (3分)
(3分)
解得: (1分)
(1分)
24、解:(1)在 物块在水平恒力F作用www.ks5 u.com下由B点匀加速直线运动到A点,设加速度为a,AB间的距离为s,则
物块在水平恒力F作用www.ks5 u.com下由B点匀加速直线运动到A点,设加速度为a,AB间的距离为s,则
 ①
①
 ②
②
 4分
4分
 ③
3分
③
3分
(2)设整个过程中F所做功为 ,物块回到A点的速度为
,物块回到A点的速度为 ,由动能定理得:
,由动能定理得:
 ④
5分
④
5分
 ⑤
4分
⑤
4分
 2分
2分
25、解:(1)A、B两车相碰后瞬间的共同速度是 ,
,
 然后A、B两车整体和物块C发生完全非弹性碰撞,系统损失的动能就是
然后A、B两车整体和物块C发生完全非弹性碰撞,系统损失的动能就是

(2)由 知,A车的初速度
知,A车的初速度 。若物块C刚好相对滑行到A车右端,对应的摩擦生热
。若物块C刚好相对滑行到A车右端,对应的摩擦生热 ,对应的
,对应的 ;若物块C刚好相对滑行到A车左端,对应的摩擦生热
;若物块C刚好相对滑行到A车左端,对应的摩擦生热 ,对应的
,对应的 。
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com