
题目列表(包括答案和解析)
(7分)某同学进行试验探究时,欲配制10%的Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在未溶物。为探究原因,该同学查得Ba(OH)2在20℃时的溶解度2.1 g。
(1)烧杯中未溶物仅为BaCO3,理由是(用化学方程式表示) 。
(2)假设试剂由大量Ba(OH)2和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、氯化铜溶液、烧杯、试管、带塞导气管、滴管
|
实验步骤 |
预期现象和结论 |
|
步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 |
|
|
步骤2:取适量滤液于试管中,滴加稀硫酸。 |
有 ① 生成,说明有Ba2+ |
|
步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中。 |
试管中有 ② 生成,烧杯中 ③ ,结合步骤2说明沉淀是BaCO3。 |
|
步骤4:取适量滤液于试管中, ④ 。 |
试管中有蓝色沉淀生成,说明有大量的OH—,综合上面步骤可知试剂由大量Ba(OH)2和少量BaCO3组成,假设成立。 |
(3)在20℃室温下, (填“能”或“不能”) 配制10%的Ba(OH)2溶液。
五、计算与分析题(共2小题,共10分)
目前已制得的纯金属只有90余种,但由这些纯金属按一定组成和质量比制得的合金已达几千种。由于合金更容易适合不同的用途,因此被大量应用于日常生活、工农业及科学研究中。结合所学知识,完成27、28题。
(本题包括1小题,共12分)
27.(11分)四硫化钠(Na2S4)固体可替代红磷测定空气中氧气的体积分数,反应原理为:2 Na2S4 + O2 + 2H2O = 8S↓+ 4 NaOH。
【实验资料】
①四硫化钠(Na2S4)的相对分子质量为 ,其中硫元素的质量分数为 (结果精确到0.1%)。
②四硫化钠受热时,会与空气中的水蒸气反应,生成少量有毒气体硫化氢。
③NaOH溶液呈碱性,可吸收硫化氢、二氧化碳、二氧化硫等酸性气体
④硫代硫酸钠(Na2S2O3)可溶于水,常温下与NaOH溶液不反应。
【实验过程】
①取碳酸钠、 硫粉混合后置于试管中,加热(如图1所示,夹持装置已略去),制得Na2S4,反应为4Na2CO3 + 12S + X  2
Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为
,蘸有浓NaOH 溶液的棉花的作用是
。
2
Na2S4+ 2 Na2S2O3 + 4CO2,X 的化学式为
,蘸有浓NaOH 溶液的棉花的作用是
。
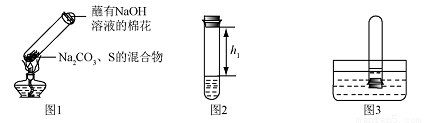
②冷却后,取下棉花,放置一段时间,再向该试管中加入10ml水,迅速塞紧橡胶塞,充分振荡,测量液面至橡胶塞下沿的距离,记录数据h1(如图2所示)
③将该试管插入水中(如图3所求),取下橡胶塞,观察到
,塞紧橡胶塞。将试管取出,倒过来,测量液面至橡胶塞下沿的距离,记录数据h2,理论上h1:h2=
④按照①~③再重复实验2次.3次实验数据如下表所示。
|
|
第1次 |
第2次 |
第3次 |
|
h1/cm |
11.2 |
11.4 |
11.6 |
|
h2/cm |
8.9 |
9.1 |
9.2 |
【解释与结论】根据第1次实验数据,计算空气中氧气的体积分数为 (结果精确到0.1%)。
【反思与评价】(1)若实验过程②中,取下棉花后,未放置一段时间即进行后续操作,会影响测定结果,请说明有何影响,并阐述理由: 。(2分)
(2)若要保证实验的效果,至少需要生成四硫化钠(Na2S4)0.174g ,则理论上实验时至少取碳酸钠粉末 克?写出计算过程(2分)
(7分)某同学进行试验探究时,欲配制10%的Ba(OH)2溶液,但只找到在空气中暴露已久的Ba(OH)2试剂。在室温下配制溶液时发现所取试剂在水中仅部分溶解,烧杯中存在未溶物。为探究原因,该同学查得Ba(OH)2在20℃时的溶解度2.1 g。
(1)烧杯中未溶物仅为BaCO3,理由是(用化学方程式表示) 。
(2)假设试剂由大量Ba(OH)2和少量BaCO3组成,设计试验方案,进行成分检验,在答题卡上写出实验步骤、预期现象和结论。
限选试剂及仪器:稀盐酸、稀硫酸、NaOH溶液、澄清石灰水、氯化铜溶液、烧杯、试管、带塞导气管、滴管
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀。 | |
 步骤2:取适量滤液于试管中,滴加稀硫酸。 步骤2:取适量滤液于试管中,滴加稀硫酸。 | 有 ① 生成,说明有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中。 | 试管中有 ②生成,烧杯中 ③ ,结合步骤2说明沉淀是BaCO3。 |
| 步骤4:取适量滤液于试管中, ④ 。 | 试管中有蓝色沉淀生成,说明有大量的OH—,综合上面步骤可知试剂由大量Ba(OH)2和少量BaCO3组成,假设成立。 |
 铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.
铜及其化合物是工业生产和日常生活中常用的物质,下面是对铜及其化合物的探究.| 配置用水 | 有浑浊 | 有浑浊 |
| 自来水 | 无浑浊 | 有浑浊 |
| 市售纯净水 | 无浑浊 | 有浑浊 |
| 医用纯净水 | 无浑浊 | 无浑浊 |
| 试验编号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| 饱和溶液 | 2 | 4 | 6 | 8 | 16 | 32 | 128 |
| 现 象 | 白色浑浊→澄清 | ||||||
 一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.
一化学兴趣小组对某月饼包装盒中的“脱氧剂”很好奇,他们观察到“脱氧剂”外包装标注的成分为铁粉、活性炭和氯化钠,打开发现灰黑色的固体中还夹杂着少量红棕色粉末.一、选择
1
2
3
4
5
6
7
8
9
10
11
12
D
A
D
C
B
A
B
D
C
B
D
C
二、填空
13.NaCl;HCl(或氯化钠,氯化氢);石蕊试液(活泼金属、碳酸盐等合理即可);液体变红(有气泡等,对应合理即可)
14.维生素 豆腐(或瘦肉、鱼类等含蛋白质的食物)
15.CaO+H2O=Ca(OH)2 ; 碱性 ;PH试纸 ;CO2+Ca(OH)2=CaCO3↓+H2O
16.(1)Fe、Cu、C、Mg(本小题全对给2分,对2个或3个给1分)
(2)2Al+3FeCl2=3Fe+2AlCl3(2分) (3)CuO+H2SO4=CuSO4+H2O(2分)
三、简答
18.(1)吸收水蒸气(或吸收水分或潮解) 吸收二氧化碳(或与二氧化碳反应或写化学方程式也可) (两空答案顺序不分先后) (2)Na2SiO3
19. (1)Ca(OH)2 CaCO3 (2)放热 (3)Ca(OH)2 和CaCO3的混合物(开放性试题,其他符合题意的猜想也可) (每小题2分)
四、实验与探究
23.⑴①排除因氢氧化钠溶液的加入,稀释盐酸而引起PH变大(或只有PH≥7才能说明盐酸已经反应掉了)
实验步骤
实验现象
取一定量10%的氢氧化钠溶液于烧杯,插入温度计测温度;加入适量10%的盐酸,用玻璃棒搅拌,再测温度。
温度计是示数上升
(或温度升高)
⑵
⑶生成蓝色沉淀
若盐酸过量,加入硫酸铜溶液时也无明显现象(或盐酸可能有剩余)
紫色石蕊试液(或锌粒、碳酸钠、氧化铜、氢氧化铜、pH试纸等)
24.将生成的气体通入到澄清的石灰水中,石灰水变浑浊
【作出猜想】嚼碎后服用疗效快(或嚼碎后药物与胃酸的反应快;或反应物的接触面积增大,化学反应加快)
【设计实验】一片研碎的药片
【拓展探究】(1)对身体无害 (2)碳酸盐与盐酸作用生成二氧化碳气体,加重胃溃疡病情
五、计算
25.(1)4.4 (1分) (2)NaCl 、HCl (3)(共3分)解:
设参加反应的碳酸钠的质量为x,反应生成的氯化钠的质量为y
Na2CO3 + 2HCl = 2NaCl + CO2↑ + H2O (1分)
106 73 117
X


=
x=


=
y=
烧杯里不饱和溶液中溶质的质量为: 117.g + (
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com