
题目列表(包括答案和解析)
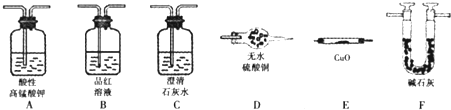
| 试管编号 | ① | ② | ③ | ④ | ⑤ |
| NaNO2含量/mg?L-1 | 0 | 20 | 40 | 60 | 80 |
| 实验方案 | 实验现象 | 实验结论 |
| 维生素C可以有效降低NaNO2的含量 |
| 实验步骤 | 实验现象 | 实验结论及离子方程式 |
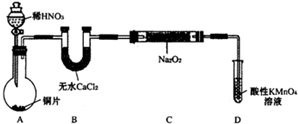
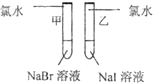 |
甲 溶液由无色变为橙色 溶液由无色变为橙色 乙 溶液由无色变为黄色 溶液由无色变为黄色 |
离子方程式 甲: 2Br-+Cl2═Br2+2Cl- 2Br-+Cl2═Br2+2Cl- 乙: 2I-+Cl2═2Cl-+I2 2I-+Cl2═2Cl-+I2 结论:卤素单质的氧化强到弱的顺序为Cl2>Br2>I2 |
| 实验步骤 | 实验现象 | 实验依据和结论 |
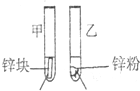 3mL1mol/L 3mL3mol/L 盐酸 盐酸 (金属质量相同,盐酸均过量) |
均有气体生成,锌粉先消失,锌块后消失 | 因为乙试管中的反应更快,所以反应物浓度越大,反应速率越快. |

| 实验方案 | 实验操作 | 实验现象 | 结论 |
| 方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
| 方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
| ③静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com