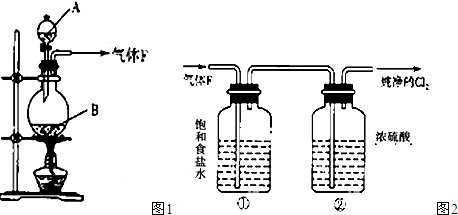
实验室用如图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:

(1)A中盛有浓盐酸,B中盛有MnO
2,则烧瓶中发生反应的化学方程式为:
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
MnO
2+4HCl(浓)
MnCl
2+Cl
2↑+2H
2O
.
(2)C中盛有饱和食盐水,其作用是
除去杂质氯化氢气体抑制C12在水中的溶解
除去杂质氯化氢气体抑制C12在水中的溶解
,D中浓硫酸的作用是
除去水蒸气干燥Cl2
除去水蒸气干燥Cl2
.
(3)E中盛有的Cl
2 的颜色是
黄绿色
黄绿色
,Cl
2 能使湿润的红色布条褪色的原因是
因为氯气和水反应生成的次氯酸具有漂白性
因为氯气和水反应生成的次氯酸具有漂白性
.
(4)F中是FeCl
2 溶液,现象是
溶液从浅绿色变为棕黄色
溶液从浅绿色变为棕黄色
,发生反应的化学方程式为
2FeCl2+Cl2=2FeCl3
2FeCl2+Cl2=2FeCl3
.
(5)G中是AgNO
3溶液,现象是
有白色沉淀生成
有白色沉淀生成
,有关化学反应的离子方程式为
Cl-+Ag+=AgCl↓
Cl-+Ag+=AgCl↓
.
(6)H中盛有NaOH溶液,其作用是
吸收多余的氯气
吸收多余的氯气
,发生反应的化学方程式为
2NaOH+Cl2 =NaCl+NaClO+H2O
2NaOH+Cl2 =NaCl+NaClO+H2O
.