
题目列表(包括答案和解析)
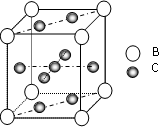 A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:
A、B、C、D、E、F 是第四周期的元素其单质均为固体,其相关的性质如下:

| ||
| ||
 A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:
A、B、C、D、E、F均是元素周期表中按原子序数依次增大的前20号元素,其中只有A、D和B、E分别是同一主族元素,B、E两元素原子核中质子数之和是A、D两元素原子核中质子数之和的两倍,又知六种元素的单质中有三种气体、三种固体.部分元素在元素周期表中的相对位置关系如下:| C | |
| E |
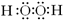
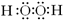
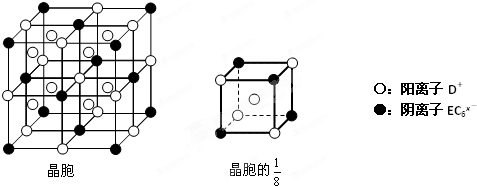
| 元素 | 相关信息 |
| A | A的第一电离能低于同周期左右相邻元素 |
| B | B原子中成对电子数等于未成对电子数的2倍 |
| C | C原子p轨道和s轨道中的电子数相等,与非金属的原子结合时形成共价键 |
| D | D与A、B、C均不同周期,其一个单质分子中只有一个σ键 |
| E | E的原子序数比所处周期中未成对电子数最多的元素大3 |
1
2
3
4
5
6
7
8
A
B
C
D
B
C
D
A
9
10
11
12
13
14
15
16
D
A
C
C
A
D
B
B
17.(1)促进, B (2)甲大 (各1分)
乙用氯化铵溶液稀释后,.files/image325.gif) 增大很多,使
增大很多,使.files/image212.gif) 的电离平衡向抑制电离的方向移动;
的电离平衡向抑制电离的方向移动;.files/image328.gif) 发生水解,使稀释后的乙溶液的
发生水解,使稀释后的乙溶液的.files/image330.gif) )增大 (答
)增大 (答.files/image328.gif) 水解使溶液
水解使溶液.files/image153.gif) 减小不给分) (2分)
减小不给分) (2分)
(3)③ 适量的.files/image036.gif) (各1分)
(各1分)
18.(1).files/image335.gif) ,
,.files/image337.gif) ;(各2分)
;(各2分)
(2)①.files/image261.gif) (1分) ②
(1分) ②.files/image340.gif) (1分)
(1分)
得.files/image342.gif)
.files/image343.gif) |
.files/image344.gif)
.files/image345.gif) ③
③.files/image347.gif) (2分)
(2分)
得.files/image349.gif)
④ 1:2 (2分)
19.(1) .files/image351.gif) (各2分)
(各2分)
(2) .files/image353.gif)
(3)0.5 1 (4) D
20.(1)第三周期.files/image355.gif) 族(2分)
族(2分)
(2) .files/image030.gif) 属于分子晶体而
属于分子晶体而.files/image358.gif) 属于原子晶体(2分)
属于原子晶体(2分)
(3) .files/image360.gif) (2分)
(2分)
(4).files/image362.gif) 、
、.files/image364.gif) 、
、.files/image366.gif) 、
、.files/image368.gif) (写出3种即可)(3分)
(写出3种即可)(3分)
21.(1) ③⑤⑦ (2) C (各2分)
22.(1).files/image076.gif) 、
、.files/image030.gif) 等(2分)
等(2分)
(2).files/image372.gif) ;
;.files/image374.gif) ;
;.files/image012.gif) (各1分)
(各1分)
(3)① .files/image377.gif) (1分)
(1分)
②a、b (各1分) .files/image379.gif) (1分) 双手紧握 (或微热) 试管丁使试管中气体逸出,
(1分) 双手紧握 (或微热) 试管丁使试管中气体逸出,.files/image034.gif) 与水接触后即可引发烧杯中的水倒流入试管丁(2分)
与水接触后即可引发烧杯中的水倒流入试管丁(2分)
③
.files/image382.gif) (2分)
(2分)
23.(1).files/image186.gif) (2)
(2).files/image385.gif) (3)
(3).files/image387.gif) (4)
(4) .files/image389.gif) (各2分)
(各2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com