
题目列表(包括答案和解析)
 A、B、C、D为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于D的质子数.D原子核内质子数和中子数相等.
A、B、C、D为短周期元素,在周期表中所处的位置如图所示,A、C两元素的原子核外电子数之和等于D的质子数.D原子核内质子数和中子数相等.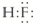
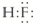
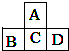 A、B、C、D为短周期元素,它们的位置关系如图所示,已知B、D两元素原子序数之和是A元素的原子序数的4倍,则下列叙述中正确的是( )
A、B、C、D为短周期元素,它们的位置关系如图所示,已知B、D两元素原子序数之和是A元素的原子序数的4倍,则下列叙述中正确的是( )| 元素 | A | B | C | D |
| 性质或结构信息 | 工业上通过分离液态空气获得其单质,单质能助燃 | 气态氢化物显碱性 | +3价阳离子的核外电子排布与氖原子相同 | 第三周期原子半径最小 |
(1)元素符号:A____________;B____________;C____________;D____________。
(2)写出化学方程式:C2和X(过量)反应:_______________________。
(3)B4A3D2的化学式为:_____________________________,其水溶液呈酸性的离子方程式是:_________________________________________________。
A、B、C、D为短周期元素,B、A可形成两种液态化合物,其原子个数比分别为1∶1和2∶1,且分子中电子总数分别为18和10;B与D能形成一种极易溶于水的碱性气体X,B与C能形成一种极易溶于水的酸性气体Y。X分子与B2A分子中的电子数相同,Y分子中的电子数为18,A、B、D形成离子化合物B4A3D2,其水溶液呈弱酸性。请回答:
(1)元素符号:A____________;B____________;C____________;D____________。
(2)写出化学方程式:C2和X(过量)反应:_______________________。
(3)B4A3D2的化学式为:_____________________________,其水溶液呈酸性的离子方程式是:_________________________________________________。
一、单项选择题(本题包括12小题,每小题4分,共48分。每小题只有一个选项符合题意)
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
A
B
A
C
B
D
C

 22.(14分)
(1) O、H、S、Cl 硫酸(4分)
22.(14分)
(1) O、H、S、Cl 硫酸(4分)
(2) (3分)
(3) SO2 + 2H2O + Cl2 = 4H++ SO42-+ 2Cl-(3分)
SO2和Cl2按相等物质的量通入品红溶液(2分)
(4) Fe + S
 FeS,2Fe + 3Cl2
FeS,2Fe + 3Cl2
 2FeCl3(或Cl2 +
H2S = S↓+ 2HCl
2FeCl3(或Cl2 +
H2S = S↓+ 2HCl
或Cl2 + Na2S S↓+ 2NaCl)(2分)
四、实验题(本大题共2小题,共21分)
23.(5分)
(1)同周期
(2)同主族
Ⅰ
A、F、H
E、D
Ⅱ
d、c、b
g、f
24.(16分) (1) 分液漏斗上口的塞子未打开(或漏斗未与大气相通或漏斗塞子的凹槽未与颈部的通气孔对准。(2分)
(2) ④ (2分)
(3) 溶液由红色褪为无色,SO2 + OH- = HSO3-或SO2 + 2OH-= SO32-+ H2O。 (4分)
(4) 产生白色沉淀,SO2被HNO3氧化产生SO42-,与Ba2+产生白色沉淀。(4分)
(5) ① 关闭K2,在烧杯中用水封住玻璃导管口,用手捂住集气瓶b,烧杯中导管口有气泡产生,松手后,导管内有一段液柱保持不降则气密性好。(2分)
② 打开K1,关闭K2,点燃酒精灯。(2分)
五、计算题(本大题共1个小题,共11分)
25.(1) S H2S Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓+ H2O
Na2S + H2SO4 = Na2SO4 + H2S↑ 2H2S+SO2=3S↓+2H2O(各1分)
(2) Na2S2O3 :0.025 mol Na2S:0.075 mol(各3分)
本资料由《七彩教育网》www.7caiedu.cn 提供!
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com