
题目列表(包括答案和解析)
(8分)反应3Fe(S)+4H2O(g)Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同)全部移走Fe3O4,其正反应速率的变化是 ②将容器的体积缩小一半,其正反应速率 其逆反应速率 ③保持体积不变,充入N2使体系压强增大,其正反应速率 其逆反应速率 ④保持压强不变,充入N2使容器的体积增大,其正反应速率 其逆反应速率
【解析】考查外界条件对反应速率的影响。铁和四氧化三铁是固体,其量多少不影响反应速率。容器容积缩小一半,压强增大,反应速率增大。体积不变,充入氮气,压强增大,但由于水蒸气和氢气的浓度不变,所以反应速率不变。保持压强不变,充入氮气,容积的容积必然要变大,从而导致水蒸气和氢气的浓度减小,因而反应速率减小。
(8分)反应3Fe(S)+4H2O(g)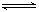 Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
Fe3O4(s)+4H2(g),在一可变的容积的密闭容器中进行,试回答:
①增加Fe的量,其正反应速率的变化是 (填增大、不变、减小,以下相同)全部移走Fe3O4,其正反应速率的变化是 ②将容器的体积缩小一半,其正反应速率 其逆反应速率 ③保持体积不变,充入N2使体系压强增大,其正反应速率 其逆反应速率 ④保持压强不变,充入N2使容器的体积增大,其正反应速率 其逆反应速率
【解析】考查外界条件对反应速率的影响。铁和四氧化三铁是固体,其量多少不影响反应速率。容器容积缩小一半,压强增大,反应速率增大。体积不变,充入氮气,压强增大,但由于水蒸气和氢气的浓度不变,所以反应速率不变。保持压强不变,充入氮气,容积的容积必然要变大,从而导致水蒸气和氢气的浓度减小,因而反应速率减小。
(6分)在一块大理石(主要成分是CaCO3)上,先后滴加1mol/LHCl溶液和0.1mol/LHCl溶液反应快的是_________________,先后滴加同浓度的热盐酸和冷盐酸,反应快的是____ ,用大理石块和大理石粉分别跟同浓度的盐酸起反应,反应快的是 。
【解析】考查外界条件对反应速率的影响。温度越高,反应越快。反应物的浓度越大,反应越快。反应物的表面积越大,反应越快。
(6分)在一块大理石(主要成分是CaCO3)上,先后滴加1mol/LHCl溶液和0.1mol/LHCl溶液反应快的是_________________,先后滴加同浓度的热盐酸和冷盐酸,反应快的是____ ,用大理石块和大理石粉分别跟同浓度的盐酸起反应,反应快的是 。
【解析】考查外界条件对反应速率的影响。温度越高,反应越快。反应物的浓度越大,反应越快。反应物的表面积越大,反应越快。
已知反应:mX(g)
+ nY(g)  qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
qZ(g) △H<0,m+n>q,在恒容的密闭容器中反应达到平衡时,下列说法正确的是
( )
A、通入稀有气体,压强增大,平衡正向移动
B、X的正反应速率是Y的逆反应速率的m/n倍
C、降低温度,混合气体的平均相对分子质量变小
D、增加X的物质的量,Y的转化率降低
【解析】考查外界条件对平衡的影响。该反应是体积减小的放热的可逆反应,若降低温度,则平衡向正反应方向移动,所以混合气体的平均相对分子质量变大,C不正确。通入稀有气体,压强增大,但物质的浓度没有变化,平衡不移动,A不正确。增加X的物质的量,可以增大其他物质的转化率,D也不正确。平衡时正逆反应速率相等,所以根据反应速率之比是相应的化学计量数之比可判断,B是正确的。答案选B。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com