
题目列表(包括答案和解析)
 (2012?揭阳一模)某校研究性学习小组探究Cu的常见化合物性质,过程如下:
(2012?揭阳一模)某校研究性学习小组探究Cu的常见化合物性质,过程如下:| 编号 | 实验操作 | 实验现象 | 结论 |
| ① | 用药匙取少许样品,加入试管A中,再用滴管取过量 |
有固体剩余,并有气泡产生 | 合金中除铝外还含有Fe、Cu 元素 |
| ② | 往试管A的剩余固体中加过量 |
固体部分溶解,并有气体放出,溶液呈浅绿色 | |
| ③ | 往试管B中加入少量 |
||
| ④ | 往②剩余固体中加入稀硝酸;再滴加 |
固体溶解,有无色刺激性气体产生并很快变成红棕色,溶液显蓝色;再加某溶液后有蓝色沉淀产生 |
下面是某化学学习小组的实验记录,请根据实验记录(部分需要补充)回答有关问题。
【研究课题】铜离子颜色的探究
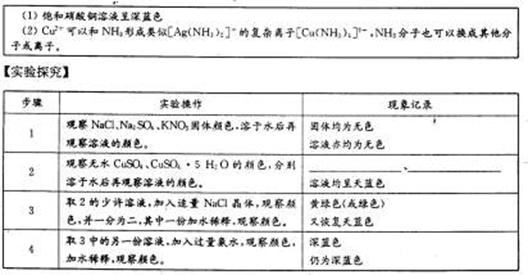 【资料卡片】
【资料卡片】
【交流讨论】
(1)以上所得溶液或物质呈天蓝色的化学粒子符号是 (写化学式,下同);实验步骤4中呈深蓝色的化学粒子符号是 ;使饱和硝酸铜溶液呈深蓝色的化学粒子符号可能是 。
(2)请写出实验步骤3中“其中一份加水稀释”的反应离子的方程式: 。
(3)有资料上介绍浓硝酸与铜丝反应后得溶液颜色显蓝色,实验中得到却是绿色溶液,试写出显绿色的可能原因 ,设计两种不同的简单的实验方法证明你的解释:
方案① ;
方案② 。
在一次实验中,某同学把铝片分别放入稀盐酸、稀硫酸中,发现铝片与稀盐酸反应的现象非常明显,而与稀硫酸几乎不反应。这和课本中“铝能跟稀盐酸或稀硫酸反应生成氢气”的说法不一致。为了排除因试剂变质等因素造成的影响,该同学在老师的指导下重新进行了下列实验,验证是否存在上述现象。
【药品】3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸、相同大小的铝片(纯度>99.5%)
【实验过程】往三支相同的试管中分别加入相同的铝片各一片,再往试管中分别加入等体积的3.0mol?L-1盐酸、1.5mol?L-1硫酸、3.0mol?L-1硫酸。观察反应进行到1、2、5、15、20min时铝与酸反应的情况。其结果如下:
通过上述实验可知,无论是用1.5mol?L-1H2SO4还是3.0mol?L-1H2SO4均无明显现象,
而3.0mol?L-1盐酸与铝片反应的现象却十分明显。
【提出问题】
(1)写出铝与酸反应的离子方程式:_____。
(2)反应1~15min内,铝与盐酸反应的反应速率逐渐加快,其原因是___________________。
(3)根据以上探究,你能对“铝与稀盐酸和稀硫酸反应差异的原因”作出哪些假设或猜想(列出两种即可)?
①___________________。
②___________________。
(4)为了验证上述假设,你设计的实验方案是___________________。
(12分)某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物的性质。过程如下:
【提出问题】
①在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
②通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③Cu0有氧化性,能被H2、CO等还原,也能被NH3还原吗?
【实验方案】
(1)解决问题①需用到的药品有CuSO4溶液、 、 (填试剂名称),同时进行相关实验。
(2)解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80—100℃时,得到黑色固体粉末,继续加热到1000℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,则A的化学式为 。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
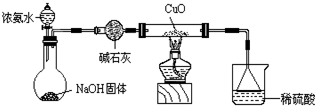
(3)为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):

实验中观察到Cu0变为红色物质。查资料可知,同时生成一种无污染的气体。
【实验结论】
(1)Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是 。
(2)根据实验方案(2),得出的+1价Cu相+2价Cu稳定性大小的结论是:在高温时 。在酸性溶液中 。
(3)CuO能够被NH3还原。
【问题讨论】
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com