
题目列表(包括答案和解析)










| ||
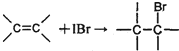
选择题:(每小题4分,共计32分)
非选择题:(共41分)
【必做部分】
26.(15分,除注明外,每空1分)
Ⅰ.(1)选择透过性
(2)成熟的红细胞除细胞膜外无其他结构的膜,便于获得纯净的细胞膜;(1分)而肾小
管壁细胞对水分子的重吸收能力强(1分 )
)
(3)③
(4)⑤ 核仁与核糖体的形成有关,核仁被破坏,不能形成核糖体,抗体蛋白的合
成不能正常进行
(5)②⑦⑨
Ⅱ.(1)蛋白质 (2)促甲状腺激素 下丘脑 (3)促进组织细胞加速摄取、利用和储存
葡萄糖,从而使血糖水平降低(2分) 反馈调节
(4)靶细胞受体无法正常识别相关的激素分子(或胰岛素)(2分)
27.(18分,除注明外,每空1分)
Ⅰ.(1)①细胞呼吸时O2的消耗量 (2分)
②(一定浓度)葡萄糖溶液、微生物悬浮液各1ml
③等量蒸馏水(答全得1分,答清水不得分)
(2)④只进行有氧呼吸(2分)
⑤不变
⑥同时进行有氧呼吸和产生酒精、CO2的无氧呼吸(2分)
⑦不变
Ⅱ.(1)肝细胞利用保存液中的葡萄糖进行有氧呼吸(1分),线粒体产生的CO2扩散
进入细胞质基质中(1分) 用不含葡萄糖的保存液
(2)丙酮酸在有氧呼吸的第二阶段和水彻底分解成CO2和氢([H])(1分),因此
可以通过检测是否有CO2产生来判断丙酮酸是否被分解。(1分)
(3)分别给1号和2号试管设置空白对照组1′和2′(1分),1′和2′试管所
装物质分别与1号和2号试管中的相同,只是在第⑤步不加入丙酮酸(1分),
而加入生理盐水(1分)
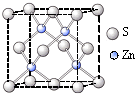
【选做部分】
34.(8分,除注明外,每空1分)
(1)B
(2)由于发酵时糖被消耗,产生酒精和CO2,酒精的密度比糖水低 (2分)
(3)酵母菌进行有氧呼吸和无氧呼吸时,均产生CO2溶于发酵液中,使pH下降(2分)
(4)碳源、氮源、水、无机盐和生长因子(2分,答出3项得1分,答全得2分)
(5)包埋
35.(8分,除注明外,每空1分)
(1)蛋白质的预期功能
(2)根据新的胰岛素中氨基酸的序列,推测出其基因中的脱氧核苷酸序列,然后利用
DNA合成仪来合成新的胰岛素基因(2分)
(3)

否
(4)农杆菌转化法
(5)蛋白质工程 基因工程
青岛市2009年高三模拟练习
理科综合物理参考解答
二、选择题(本题包括7小题,每小题给出的四个选项中,有的只有一个选项正确,有的有多个选项正确,全部选对的得4分,选对但不全的得2分,有选错的得0分)
16.B 17.AC 18.D 19.A 20.B 21.ABD 22.BC
23.(1)(5分) ,(1分),
,(1分), (2分),
(2分), (2分)
(2分)
(2)(8分)电压表读数变化很小(1分),新电池的内阻很小,内电路的电压降很小.(1分)
①防止变阻器电阻过小时,电池被短路或电流表被烧坏(或限流,防止电源短路).(2分)
② (2分)
③
(2分)
③ (2分)
(2分)
24.(15分)参考解答:
(1)小球到达斜面顶端时  …………………………(1分)
…………………………(1分)
 …………………………(1分)
…………………………(1分)
 …………………………(1分)
…………………………(1分)
解得: …………………………………………(1分)
…………………………………………(1分)
(2)在 B 点, ……………………………………(1分)
……………………………………(1分)
小球由 B 到 C 过程中,  ……………………(2分)
……………………(2分)
 …………(1分)
…………(1分)
 ……………………(1分)
……………………(1分)
解得: …………………………………………(1分)
…………………………………………(1分)

(3)小球在水平面上的运动过程中,
 ……………………(3分)
……………………(3分)
解得: ……………… …………………………(2分)
……………… …………………………(2分)
25.(17分)参考解答:
(1)当金属棒匀速运动时,
进入磁场前, …… ……… ……… ………… ………(1分)
…… ……… ……… ………… ………(1分)
进入磁场后, …… ………… ………… ………(1分)
…… ………… ………… ………(1分)
 …… ………………… …… ………(1分)
…… ………………… …… ………(1分)
 … ………………… …… ………(1分)
… ………………… …… ………(1分)
解得: …… ………………… … ………(1分)
…… ………………… … ………(1分)
(2)金属棒在磁场外运动过程中,
 …………………………………(2分)
…………………………………(2分)
穿过 n
段磁场过程中, … … …… … ………(2分)
… … …… … ………(2分)
所以拉力做功为:
 … ……(1分)
… ……(1分)
(3)金属棒进入磁场前, … ………(1分)
… ………(1分)
穿过第一段磁场过程中, ………(2分
………(2分 )
)
金属棒从穿出第一段磁场到进入第二段磁场的过程中,
 ……………………… …… ………(1分)
……………………… …… ………(1分)
整个过程中电阻上产生的总热量为: …… ………(2分)
…… ………(2分)
解得: …………………… …… ………(1分)
…………………… …… ………(1分)
36.(1)AC(4分)
(2)设活塞截面积为 S,开始排气时气体长度为 L,由玻意耳定律知
 (2分)
(2分)
∴  (1分),即活塞向左运动
(1分),即活塞向左运动  时空压机开始排气(1分).
时空压机开始排气(1分).
37.(1)鸣着汽笛迎面而来的汽车,人感觉到汽笛声越来越高(2分).
(2)-x方向(1分),
(3)设单摆原长为 ,由题意得
,由题意得
 (1分),
(1分), (1分)
(1分)
所以重力加速度为 (2分).
(2分).
38.(1) ,人工核反应;
,人工核反应; ,衰变.(每空1分,共4分)
,衰变.(每空1分,共4分)
(2)根据动量守恒定律  (1分)
(1分)
∴ (1分)
(1分)
未知核的质量数为
 (1分),即该未知核为氦核.(1分)
(1分),即该未知核为氦核.(1分)
青岛市2009年高三模拟练习
理科综合参考答案及评分标准 2009.05
理科综合(化学)参考答案
9.A 10.C 11. A 12.B 13.B 14.C 15.C
28.(共13分)
I、(1)减小压强(1分); 吸热 (1分) (2) 20%(2分);
(3)0.84 (2分); K1=K2=K3<K4 (1分)
II、(1)-31(2分);
(2)SiHCl3+H2 Si +3HCl (2分);
Si +3HCl (2分);
(3)氯化氢、氢气(2分,漏掉一个扣1分)
29.(共16分)
(1) C S (每空1分)
(2) Al2(SO4)3 (1分)
H2SO4或H2SO3或H2CO3(1分,其它合理答案也可)
1014―
(3)① H+ + AlO2- +
H2O = Al(OH)3↓(1分) 
Al(OH)3+3 H+= Al3++ 3H2O (1分)
② c(Na+)>c(HCO3-) >c(SO42-)>c(OH-)>c(H+)>c(CO32-) (2分)
(4)2NH4ClO4
 N2↑ + 4H2O↑ +
Cl2↑ + 2O2↑; (2分,化学式错、不配平均不给分,漏条件和“↑”符号扣1分)
N2↑ + 4H2O↑ +
Cl2↑ + 2O2↑; (2分,化学式错、不配平均不给分,漏条件和“↑”符号扣1分)
N2 、O2 (1分,漏掉一个不得分); 7NA 或4.214×1024 (1分)
30.(共13分)(1)浓硝酸(1分)
(2)3Cu + 8H+ + 2NO3-= 2NO↑ + 3Cu2+ + 4H2O(2分)
(3)①有利于氮氧化合物的吸收(1分)
②防止倒吸(1分)
(4)泥三角、用玻璃棒搅拌、干燥器(各1分,共3分)
吸水剂(1分), 加CaO后蒸馏(或蒸馏也可)(1分),
蒸馏烧瓶、温度计、承接管(牛角管)、锥形瓶、冷凝管(3分,写出3种仪器得1分,写出4种得2分)
31.【化学――化学与技术】( 8 分)
(8分)(1)充分利用潮汐能、风能、太阳能等海边富有的洁净能源(2分,其它合理答案也得分)
(2)CH2=CHCOONa (2分)
(3) ① SO2+Br2+2H2O=4H++2Br-+SO42- (2分) ② 萃取 分液 蒸馏 (2分)
32.【化学―物质结构与性质】( 8 分)
(1)1s22s22p63s23p63d104s1(或[Ar] 3d104s1)(2分);
Al<Mg< S<N(1分)
(2)MgCl2为离子晶体而AlCl3为分子晶体(1分)
(3)sp2(1分),V形(1分)
(4)Cu3 N (2分)
33.【化学―有机化学基础】( 8 分)
(1) (2分)
(2分)  (2分)
(2分)
(2)①②⑤ (1分) (3)6(1分)
(4) (2分)
(2分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com