
题目列表(包括答案和解析)
某废液中主要含有NaCl、NaI,实验室从该废液中回收I2和NaCl的流程如下: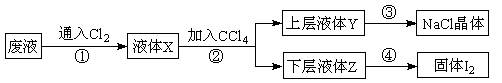
回答下列问题:
(1)在步骤①中通入的Cl2与NaI发生置换反应生成I2,其反应的化学方程式为
__________________________________________________________________________。
(2)步骤②操作名称是 ,用到的玻璃仪器有________________________。
(3)下层液体Z的颜色是 ,步骤④操作的名称是 。
(4)要从上层液体Y中得到NaCl晶体,步骤③操作中需要的实验仪器有_______________。
| A.试管 | B.蒸发皿 | C.漏斗 | D.玻璃棒 E.坩埚 F.酒精灯 G.烧瓶 |
根据以上信息,结合自己所掌握的化学知识,回答下列问题:
①在CuSO4溶液和“另一物质”制CuH的反应中,用氧化还原观点分析,这“另一物质”在反应中所起的作用是_______________(填“氧化剂”或“还原剂”)。
②如果把CuH溶解在足量的稀硝酸中生成的气体只有NO,请写出CuH溶解在足量稀硝酸中反应的化学方程式(不必配平):_________________________________。该反应中的氧化产物是________________。
(2)下图中,P为一个可以自由滑动的活塞。关闭K,分别向A、B两容器中各充入2 mol X和2 mol Y,在相同温度和有催化剂存在的条件下,两容器中各自发生如下反应:

2X(g)+Y(g)![]() 2Z(g)+2W(g)
2Z(g)+2W(g)
已知:起始时,VA=
①A、B两容器达到平衡的时间tA________________tB(填“大于”“小于”或“等于”);
②计算该温度下反应的化学平衡常数K=___________;
③当A、B分别达到平衡时,B容器中Y的转化率为____________,两容器中W的体积分数关系为A____________B(填“大于”“小于”或“等于”);
④打开K,一段时间后反应再次达到平衡,则此时B的体积为____________。
某废液中主要含有NaCl、NaI,实验室从该废液中回收I2和NaCl的流程如下:

回答下列问题:
(1)在步骤①中通入的Cl2与NaI发生置换反应生成I2,其反应的化学方程式为
__________________________________________________________________________。
(2)步骤②操作名称是 ,用到的玻璃仪器有________________________。
(3)下层液体Z的颜色是 ,步骤④操作的名称是 。
(4)要从上层液体Y中得到NaCl晶体,步骤③操作中需要的实验仪器有_______________。
A.试管 B.蒸发皿 C. 漏斗 D.玻璃棒 E.坩埚 F.酒精灯 G.烧瓶
一、单项选择题(每小题3分,共45分,多选、错选、不选均为零分)
l.B 2.B 3.C 4.A 5.A 6.C 7.D 8.B 9.D
10.A 1l.D 12.C 13.B 14.B 15.A
二、填空题(共30分。化学方程式不配平不给分,以下各大题同)
16.(共4分)碱性(2分) (2分)
(2分)
17.(共5分)(1) (2分)
(2分)
(2)15(3分)
18.(共10分)①吸热(2分) ②小于(2分)
③升温、减压、减少Z等(其它满足题意的答案也可)(每空2分 共4分)
④使用催化剂(2分)
19.(11分)(2)酸式(1分)
(3)碱式滴定管、锥形瓶(各1分,共2分)红色(1分)无(1分)
(4)80%(3分)(5)A C E(各1分,共3分,有多选或错选均不给分)
三、推断题(共7分)
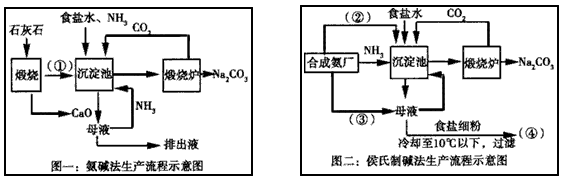
20.(1) (2分)
(2分)
(2)碱石灰(1分),

 (2分)
(2分)
(3) (2分)
(2分)
四、实验题(共8分)
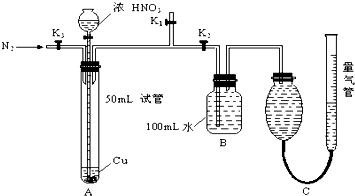
21.(1)排除装置中的空气,防止生成的 被氧化(1分),
被氧化(1分), (1分),
(1分), (1分)
(1分)
(2)使生成的 尽量与B瓶中的水反应(1分)
尽量与B瓶中的水反应(1分)
(3) (1分),保持两边液面相平,平视读数。(1分)
(1分),保持两边液面相平,平视读数。(1分)
(4)有(1分),若只由 和水产生
和水产生 ,则C装置中气体的总体积不等于120mL(1分)
,则C装置中气体的总体积不等于120mL(1分)
五、计算题(共10分)
22.(1) (1分),
(1分), (1分)
(1分)
(2)
若原溶液只有 ,则反应的铁粉质量为:
,则反应的铁粉质量为: (1分)
(1分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com