
题目列表(包括答案和解析)
| |||||||||||||||||||||||||||||||||||
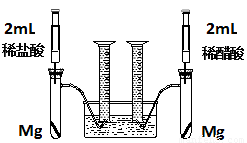
(18分)实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)=c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
(18分)实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB-
HB- H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
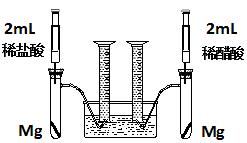
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是 。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB-![]() H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
实验一:某化学小组为比较盐酸和醋酸的酸性,设计了如下实验方案。装置如图:
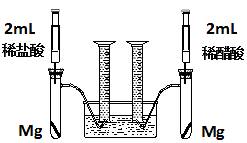 实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
实验方案:在两试管中分别加入过量镁条,同时将两注射器中的溶液注入相应试管中,观察产生氢气的速率和体积。
(1)盐酸与镁反应的离子方程式为 。
(2)在上述实验方案中有一明显欠缺,该欠缺是
。
(3)在欠缺已经改正的方案下,反应起始时,产生氢气的速率关系应是 ;最终产生氢气的体积关系应是 。
(4)实验中产生的氢气体积比理论值高,可能原因是 。
(5)通过比较起始反应的速率可以得出的结论是 。
(6)除上述方法外,还可以通过其他方法比较盐酸和醋酸的酸性,请写出其中一种更简单的方法
。
实验二:某二元酸(H2B)在水中的电离方程式是: H2B=H++HB- HB- H++B2-
H++B2-
回答下列问题:
(1)请判断H2B是强电解质还是弱电解质?
(2)已知0.1mol·L-1 NaHB溶液的pH=2,则0.1mol·L-1 H2B溶液中氢离子的物质的量浓度应 0.11 mol·L-1(填“<”,“>”或“=”)
(3)在0.1mol/L的Na2B溶液中,下列离子浓度关系式正确的是_______。
A.c(H+)+c(HB-)+c(H2B)=0.1mol/L B.c(Na+)+c(OH-)=c(H+)+ c(HB-)
C.c(Na+)+ c(H+)= c(OH-)+ c(HB-)+2c(B2-) D.c(Na+)=2c(B2-)+2 c(HB-)
(4)0.1mol/LNaHB溶液中各种离子浓度由大到小的顺序是_______________________。
1.D 2.D 3.D 4.B 5.B 6.A 7、B 8、C 9、C 10、B 11、C 12、D
13、C 14.C 15.D 16.B 17.B 18.C 19.A 20.D
21.
(1)
(2)
(3) 将多用电表的选择开关旋至高倍率的欧姆挡(如×100)再次调整欧姆零点,然后将黑表笔接触二极管的负极,红表笔接触二极管的正极,把读得的欧姆数乘以欧姆挡的倍率,即为反向电阻
(4) 电流表外接,滑动变阻器用分压式接法
22. (1)
23.
解:(1)对小物块,由A到B有
 …………1分
…………1分
在B点 …………2分
…………2分
所以 …………1分
…………1分
(2)对小物块,由B到O有
 …………2分
…………2分
其中 …………1分
…………1分
在O点 …………1分
…………1分
所以N=43N
由牛顿第三定律知对轨道的压力为 …………1分
…………1分
(3)物块沿斜面上滑: …………1分
…………1分
所以
物块沿斜面上滑: …………1分
…………1分
由机械能守恒知
小物块由C上升到最高点历时 …………1分
…………1分
小物块由最高点回到D点历时 …………1分
…………1分
故 …………1分
…………1分
即 …………1分
…………1分
(4)小物块在传送带上加速过程: …………1分
…………1分
PA间的距离是 …………1分
…………1分
24 . (1) 750W (2) 12J
25、1)N
2)C3N4; Al
3)离子键、共价键
4)比较其最高价氧化物对应水化物的酸碱性。
26、1)A:FeS C:H2S E:FeCl3
2))SO2+2Fe3++2H2O == 2Fe2++SO42-+4H+
3)Fe3+ 1S22S22P63S23P63d10 是半满状态所以稳定
27、1)铜、锌及浓盐酸一起组成了原电池,加快了反应速率
2)1、没有道理,因为氢气本身难溶于水
2、将铜片加入稀硫酸中,微热 ; 若无气体放出,则不含锌等活泼金属杂质;若有气体则有锌等杂质
3)白色沉淀加入稀盐酸中,通入氧气; 溶液变蓝色,说明是一价铜
向氯化亚铜悬浊液中加入氯化钾浓溶液; 若白色沉淀消失且得无色溶液,则原白色沉淀为氯化亚铜,否则不是
4) 1、 2Cu + 8HCl = 2H3[CuCl4] + H2↑
或: 2Cu + 6HCl= 2H2[CuCl3] +H2↑
2Cu +4HCl = 2H[CuCl2] +H2↑
2、[ CuCl4]3- == CuCl ↓ + 3Cl-
或 [CuCl3]2- ==CuCl ↓ + 2Cl-
[CuCl2]-==CuCl ↓ + Cl-
28、1)略
2)略
3)3
4)6 (NH2)2CO → C3H6N6 + 6 NH3 + 3 CO2
5)家庭测试奶粉中是否含三聚氰胺的实验,步骤如下:
用比平常浓的分量奶粉用热水冲,充分搅拌到不见固块,然后放入冰箱,待牛奶静置降温、过滤。如果有白色固体滤出,则用清水冲洗几次,排除其他物。如果冲洗后发现有白色晶体,可以将晶体放入清水中,该晶体如果沉入水底。那就很可能是三聚氰胺,这种奶粉不能用了。(大意相同即可)
29.(20分)
(1)①光反应(1分)
色素的数量(1分)  (1分) 光照强度(1分)
(1分) 光照强度(1分)
②白天增加光照强度和夜间适当减低温室内的温度(2分) 因为在该光照强度以下增加光照强度可提高光合作用强度;低温时呼吸速率低(2分)
(2)植株过密,叶片接受光照不足、通风不良,影响叶绿体进行光合作用;植株过密,单位空间中的线粒体多,细胞呼吸强度增加.结果造成小麦果实中积累的有机物不增加或增加很、或减少.(4分)
(3)步骤一:将提取的完整线粒体和叶绿体悬浮液,分别加入盛有丙铜溶液和 溶液的两支大小相同编号为1、2的试管中,经予充足光照.(2分)
溶液的两支大小相同编号为1、2的试管中,经予充足光照.(2分)
步骤二:分别用澄清的石灰水和点燃的卫生香检验1号和2号试管中产生的气体(2分)
实验现象:1号试管产生的气体使澄清的石灰水变浑浊,2号试管产生的气体使点燃的卫生香燃烧更猛烈(2分)
实验结论:线粒体内发生细胞呼吸过程产生 ,叶绿体内发生光合作用产生
,叶绿体内发生光合作用产生 。(2分)
。(2分)
30 . ( 12 分,每空2分) ( l )温度 ( 2 )液泡
( 3 )第三步: A 和 C 烧杯置于
第五步:用电导仪分别测量溶液的电导度,并记录实验结果
结果预测: B 烧杯中溶液导电度减去 D 烧杯中溶液导电度的值大于 A 烧杯中溶液导电度减去 C 烧杯中溶液导电度的值(只要答案合理并与第三步的答案对应就给分)
讨论:排除空气中的 CO2等因素干扰实验结果
30.Ⅰ(12分,每空2分).(1)无纹、条纹 黄色、绿色 无纹、绿色
(2)见下图

(3)AA, 1/4
Ⅱ(10分,每空2分).(1)呼吸作用 (有机物中)稳定的化学能
(2)1.1×105 (3)13.9% (4)能量流动逐级递减以及维持各营养级较高的输出量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com