
题目列表(包括答案和解析)
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为___________________________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为___________________________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。

a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O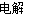 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
| |||||||||||||||||||||
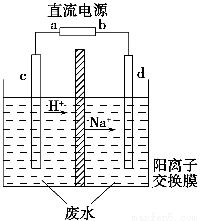
 某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是
某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是
A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e—=H2↑
C.diluent和concentrated的中文含义为浓缩的、稀释的
D.该过程中的副产品主要为H2SO4
(8分)目前世界上比较先进的电解制碱技术是离子交换法,如图为离子交换膜法电解饱和食盐水的原理示意图。
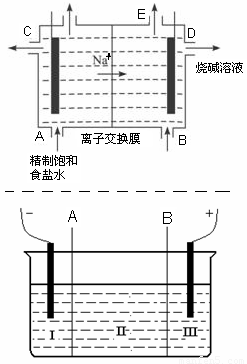
(1)下列说法不正确的是
A.从E口逸出的气体是H2
B.从B口加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4 L Cl2,便产生2 mol NaOH
D.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加 Na2CO3溶液
(2)现有离子交换膜A和B将电解槽分为I、II、III三个区域(下图所示),在这种电解池中电解Na2SO4溶液可制得氢氧化钠、硫酸等物质。A为 离子交换膜、B为 离子交换膜(填“阴”或“阳”),电极均为惰性电极。Na2SO4溶液应该在 区(填“I”、“II”、“III”)加入。通电电解时阴极的电极反应式为 ,在III区得到 。当外电路总共通过30 mol电子时,生成的NaOH 960克,则电解过程中能量的转化率为:
一、选择题(本题包括9小题,每小题3分,共27分。每小题只有一个选项符合题意。)
题号
1
2
3
4
5
6
7
8
9
答案
D
A
B
C
D
B
C
B
D
二、选择题(本题包括9小题,每小题4分,共36分。每小题有一个或两个选项符合题意。若正确答案包括两个选项,只选一个且正确的给2分,但只要选错一个,该小题就为0分。)
题号
10
11
12
13
14
15
16
17
18
答案
AC
AD
AB
C
D
C
AD
B
C
三.(本题包括3小题,,共34分)
19.(14分)
(1)烧杯、玻璃棒,过滤,换过滤器并重新进行过滤操作(4分,每空1分)
(2)NaOH、Na2CO3(2分) (其他合理的试剂也可给分)
(3)NaOH , C (2分,各1分)
(4)除去NaOH和Na2CO3(2分)
(5)蒸发皿,蒸发皿中有大量固体析出(2分,各1分)
(6)加快沉淀生成 , 5.61×10―8 mol?L―1。(2分,各1分) ]
20.(7分)
(1)掩蔽Fe3+,防止造成偏大的误差(1分)
(2)提供酸性条件,抑制Cu2+的水解(1分)
(3)防止空气中的氧气与碘化钾反应(1分)
(4)2Cu2++4I-=2CuI↓+I2 (2分)
(5)ω(Cu)= 64CV/
21.(13分) (1分)
⑴(2分)测定pH 或滴加Na2CO3溶液 或将甲酸滴加到滴有酚酞的NaOH溶液中(不能用Na,其它合理答案均可得分)
⑵(2分)测定HCOONa溶液的pH;或将等pH的HCOOH溶液和HCl溶液稀释相同倍数,测其pH的变化;或比较等浓度甲酸和盐酸的导电性等(合理均可给分)
⑶(2分)出现银镜,由于羟基对醛基的影响,导致甲酸中的醛基不具有典型醛基的性质(1分。羧基中C原子和2个O原子之间形成1个大л键,而使甲酸分子中的醛基性质不太典型);或答稀氨水量不足,使甲酸与银氨溶液混合后仍显酸性(1分)
⑷ ① 甲酸在浓硫酸的作用下脱水生成CO和H2O(2分)
 ②(4分)
②(4分)
四.(本题包括3小题,共34分)
22.(9分)(每空各1分)
(1)氮气 ,氮化硅(化学式同样给分)
(2)K=[c(CO)]6/[c(N2)]2
(3)< , 减小,6 mol•L-1.min‑1
(4)升高温度或增大压强 , t3∽t4
(5)50% (3分)
23.(11分)
(1)D (1分)
(2)Cu (1分)
(3)H2 (1分) ;①随着反应进行生成铝离子浓度增大,水解程度增大,产生H+的浓度增大;②该反应放热,升高温度反应加快; ③铜与铝构成原电池,加快铝溶解。(3分)
(4)A、B、D (3分)
(5)A(1分),电解质性质(合理解答同样给分) (1分)
24.(12分)
|