
题目列表(包括答案和解析)
请填写下列空白:
(1)相同条件下,二甲醚与乙醇的燃烧热_________________(填“相同”或“不同”),理由是____________________________________________________________________。
(2)二甲醚可由合成气(CO+H2)在一定条件下制得。用合成气制二甲醚时,还产生了一种可参与大气循环的无机化合物,该反应的化学方程式可能是_________________________。
(3)制备二甲醚的合成气可由甲烷与水蒸气或二氧化碳经高温催化反应制得。合成气除制二甲醚外,还可用于冶炼金属,用它冶炼铁的生产过程可示意如下:

①在催化反应室中进行的反应均为可逆反应,增大体系的压强对甲烷转化率的影响是____________(填“增大”“减小”或“不变”)。
②在上述炼铁过程的某时间段内,若有x m3(标准状况)的甲烷进入燃烧室中充分燃烧,还原反应室有5y kg(即![]() ×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气___________ m3(标准状况)。
×103 mol)铁生成,假设燃烧室与还原反应室产生的高温尾气全部进入催化反应室,则这些高温尾气在理论上可产生合成气___________ m3(标准状况)。
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是
A.二甲醚分子中只含有极性键 B.二甲醚为不可再生能源
C.以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式为:CH3OCH3 - 12e- + 12OH- = 2CO2 + 8H2O
D.二甲醚燃烧的热化学方程式表示为:CH3OCH3(g) + 3O2(g) = 2CO2(g) + 3H2O(g);△H = - 1455 kJ/mol
二甲醚(CH3OCH3)被称为21世纪的新型燃料,它清洁、高效、具有优良的环保性能;二甲醚是一种无色气体,具有轻微的醚香味,其燃烧热为1455 kJ/mol;工业上用合成气(CO、H2)直接或间接制取二甲醚。下列叙述正确的是
A.二甲醚分子中只含有极性键
B.二甲醚为不可再生能源
C.以二甲醚、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。该电池中负极上的电极反应式为:CH3OCH3 - 12e- + 12OH- = 2CO2 + 8H2O
D.二甲醚燃烧的热化学方程式表示为:CH3OCH3(g) + 3O2(g) = 2CO2(g) + 3H2O(g);△H = - 1455 kJ/mol
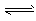 CH3OH(g) ΔH=a kJ·mol-1
CH3OH(g) ΔH=a kJ·mol-1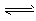 CH3OCH3(g) + H2O(g) ΔH=b kJ·mol-1
CH3OCH3(g) + H2O(g) ΔH=b kJ·mol-1 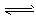 CO2(g) + H2(g) ΔH=ckJ·mol-1
CO2(g) + H2(g) ΔH=ckJ·mol-1 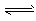 CH3OCH3(g) + CO2 (g)的ΔH= __________ kJ·mol-1。
CH3OCH3(g) + CO2 (g)的ΔH= __________ kJ·mol-1。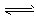 CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下
CH3OCH3(g) + H2O(g)某温度下的平衡常数为400 。此温度下,在密闭容器中加入CH3OH ,反应到某时刻测得各组分的浓度如下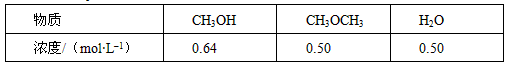
 CH3OH(g) △H1=-90.7 kJ . mol-1①
CH3OH(g) △H1=-90.7 kJ . mol-1① 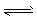 CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ . mol-1 ②
CH3OCH3(g)+H2O(g) △H2 =-23.5 kJ . mol-1 ②  CO2(g)+H2(g) △H3=-41.2 kJ . mol-1 ③
CO2(g)+H2(g) △H3=-41.2 kJ . mol-1 ③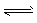 CH3OCH3(g)+CO2(g),则该反应的△H ___,平衡常数表达式为___,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会____(填升高、降低或不变)。
CH3OCH3(g)+CO2(g),则该反应的△H ___,平衡常数表达式为___,在恒温、可变容积的密闭容器中进行上述反应,增大压强,二甲醚的产率会____(填升高、降低或不变)。 CH3OCH3(g)+3H2O(g) △H>0。 该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是____。
CH3OCH3(g)+3H2O(g) △H>0。 该反应在恒温、体积恒定的密闭容器中进行,下列不能作为该反应已达到化学平衡状态的判断依据的是____。 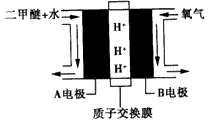
A卷
1.C 2.B 3.C 4.B 5.B 6.C 7.B 8.A 9.B 10.A 11.A 12.C 13.C 14.B 15.B
16. ①Fe3++3H2O Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
Fe(OH)3+3H+
②2Fe3++Fe=3Fe2+
③Fe3++SCN…=[Fe(SCN)]2+
④Fe3++3NH3?H2O=Fe(OH)3+3NH4+ ⑤2Fe3++H2S=2Fe2++S↓+2H+(每个2分)
17. CH3OCH3+16OH--12e-=2CO32 -+11H2O;3O2+6H2O+12e-===12OH-;CH3OCH3+4OH-+3O2=2CO32 -+5H2O(每个2分)
18. (1)① Mg2+、SO42−、H+ ②Ba2+、NO3−、OH−;(全对给2分,答不全但答到H+ 或OH−得1分)
19. (1)0.2 mol(1分)(2)SO2、NO2(1分) (3)AC(全对给2分,答不全得1分)
20. (1)H2(1分)(2)①Fe+2H+=Fe2++H2↑②AlO2-+4H+=Al3++2H2O
③4Fe2++8NH3?H2O+O2+2H2O=4Fe(OH)3↓+8NH4+或:Fe2++2NH3?H2O=Fe(OH)2↓+2NH4+、 4Fe(OH)2+O2+2H2O=4Fe(OH)3(每个2分)
(3) Al3+和Na+(全对给2分,答不全得1分) (4) H2SO4、HNO3(全对给2分,不全得1分)
21. (1)ECDBAGF(2分);酚酞(1分);无色变为浅红色(或粉红色)且半分钟不褪去(2分);
(2)偏大(1分)(3)100.00mL容量瓶(1分)(4)偏小 偏小 偏大(每个1分)
(5)4.20mol/L(2分)
22. (1) 7g;8g;(2) 3.5mol/L
B卷
B卷:23.C 24.D 25.C 26.B 27.B 28.C 29.D 30.C
31.(1)3.6 mol (2)≥0(说明:答“任意值”可得分)(3)3.6 mol< n(SO3)≤4 mol(每个2分)
32. (1)NH4C1、① ;(2)NH4Cl和NH3?H2O(答NH4Cl和NH3也给分);NH4Cl和HCl;
(3)小于 大于;(每个1分)
33. (1)将Fe3+ 还原为Fe2+;析出(或分离、或得到)FeSO4?7H2O;(每个2分)
(2) FeSO4?7H2O 石灰(或碳酸钙、废碱);(每个1分)
 (3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
(3)TiO2+2C+2Cl2 TiCl4+2CO(2分);CO(1分);①TiCl4+2Mg△ㄔㄔTi+2MgCl2(2分);②防止高温下Mg(Ti)与空气中的O2(或CO2、N2)作用(2分)③加入足量盐酸,除去金属镁,过滤,并用蒸馏水洗涤固体得金属钛。(2分)
34. (1)0.6 mol/L (2分);(2)97.5mL(2分);(3)35mL(3分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com