(2008?阜宁县模拟)通过近一个学期的化学学习,你已经掌握了实验室制取气体的有关规律,以下是老师提供的一些实验装置.请结合下图回答问题:
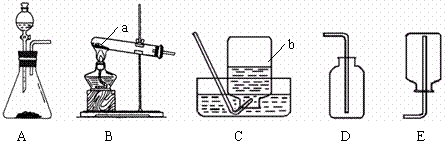
(1)写出图中标号的仪器名称:a
试管
试管
b
集气瓶
集气瓶
.
(2)①写出实验室用B装置制取氧气的化学方程式
;
②选用C装置收集较纯净氧气的适宜时刻是
C
C
.
A.当导管口刚有气泡冒出时 B.当导管口停止冒出气泡时 C.当导管口有连续均匀的气泡冒出时
③实验室用A装置制取氧气,发现锥形瓶中的反应很剧烈,应该采取的安全措施是
A
A
A.减慢液体滴加的速度 B.换用体积较小的锥形瓶 C.加热锥形瓶
(3)鸡蛋壳的主要成分是碳酸钙.小明同学进行了如下实验,并进行相关计算,请你参与他的活动.
实验组装与准备:经过分析,小明选取A、D装置并进行适当地改动、组装,如图.
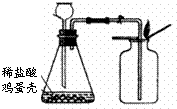
①小明认为装药品前首先进行的操作是
检查装置的气密性
检查装置的气密性
;
②如果用上图装置制取气体,反应进行较长时间后,用燃着的火柴放在集气瓶口,火焰仍不熄灭的原因是
长颈漏斗下端管口未伸入液面以下,气体从长颈漏斗逸出
长颈漏斗下端管口未伸入液面以下,气体从长颈漏斗逸出
实验设计:
Ⅰ设计思路:根据鸡蛋壳与稀盐酸反应生成二氧化碳的体积,求出生成二氧化碳的质量,再计算所需鸡蛋壳的质量.
Ⅱ操作步骤:将含杂质20%的鸡蛋壳洗净、干燥并捣碎后,取一定的质量,放在锥形瓶里,然后往锥形瓶中加入足量的稀盐酸,(假设其他杂质不与盐酸反应,反应生成的气体全部进入集气瓶中)充分反应后,生成标准状况下的二氧化碳气体2.2L(标准状况下,二氧化碳的密度为2.0g/L).
Ⅲ数据处理:根据上述实验数据,进行相关计算.
计算过程:
请计算所需鸡蛋壳的质量.
实验反思与评价:
①误差分析:实验中,如有部分生成的二氧化碳气体因溶解于水而没有全部逸出,造成计算结果与实际值相比
偏小
偏小
(填写“偏大”、“偏小”或“不变”).
②实验操作中,将鸡蛋壳捣碎的目的是
增大反应物的接触面积,使反应充分进行
增大反应物的接触面积,使反应充分进行
.

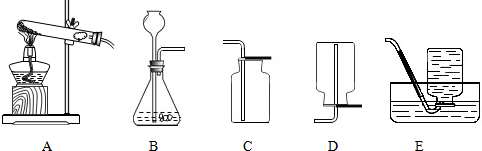
 在初中的学习中我们掌握了氧气、二氧化碳等气体的制取和收集方法.某校化学兴趣小组的同学,按规范的操作要求,运用合理的装置在实验室制取了这些气体.下图是他们实验中用过的仪器.请回答下列问题:
在初中的学习中我们掌握了氧气、二氧化碳等气体的制取和收集方法.某校化学兴趣小组的同学,按规范的操作要求,运用合理的装置在实验室制取了这些气体.下图是他们实验中用过的仪器.请回答下列问题:
