
题目列表(包括答案和解析)


| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
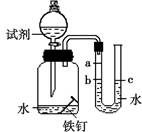
| ①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中. | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II. | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关, 温度越高,铁的锈蚀速率越快 温度越高,铁的锈蚀速率越快 . |
| ②氧气含量 | 在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气. 在相同温度下,向I、II两套装置的集气瓶中分别通入氧气和空气. |
铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I<II. 铁钉均锈蚀,且U型管中液面由b处上升至a处所需时间I<II. |
铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快. |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇. | 两套装置中铁钉均锈蚀; 且U型管中液面均由b处上升至a处,则所需时间I<II. |
铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快. 铁的锈蚀速率与水溶液的导电性有关,在能导电的溶液中,锈蚀的速率加快. |
(8分)研究金属的腐蚀对资源的利用和保护意义重大。
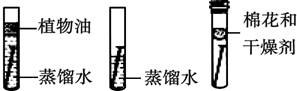
(1)为了探究铁锈蚀的条件,进行如图-12所示实验。经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。
A B C
① 通过实验发现:铁锈蚀是铁与_____________发生化学反应的过程。
② A中加入的蒸馏水要事先煮沸,其目的是______________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
【提出问题】铁锈蚀速率与哪些因素有关。
【查阅资料】① 物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液。
② 氯化钠溶液能导电;乙醇溶液不能导电。
【猜想】铁的锈蚀速率与下列因素有关:
①反应时的温度;② 氧气的含量;③ 水溶液的导电性。
|
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II。 | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,_______。 |
| ②氧气含量 |
_________。 |
________。 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇。 | 两套装置中铁钉均锈蚀; 且U型管中液面均由b处上升至a处,则所需时间I < II。 |
_______。 |
(3)若将两根铁钉分别放入两支试管中,在一支试管中加入稀硫酸,另一支试管中加入稀盐酸,观察到两支试管内均有大量气泡产生,铁钉逐渐溶解,在酸溶液中被快速腐蚀。
【反思与提高】
根据该探究实验以及你所学的知识,判断下列说法正确的是________(填序号)。
A.金属的腐蚀是指金属单质与其它物质发生化学反应的过程[
B.金属越活泼,就越容易被锈蚀
C.金属腐蚀不一定要有氧气参加
(8分)研究金属的腐蚀对资源的利用和保护意义重大。
(1)为了探究铁锈蚀的条件,进行如图-12所示实验。经过一周后观察,试管A和C中的铁钉无明显变化,试管B中的铁钉明显锈蚀。
A B C
①通过实验发现:铁锈蚀是铁与_____________发生化学反应的过程。
② A中加入的蒸馏水要事先煮沸,其目的是______________________。
(2)家中的刀具若沾有食盐水锈蚀更快。为了进一步探究影响铁锈蚀速率的因素,做了如下的实验。
【提出问题】铁锈蚀速率与哪些因素有关。
【查阅资料】①物质溶解在水中得到的混合物称为水溶液,如氯化钠溶解在水中得到氯化钠溶液,乙醇溶解在水中得到乙醇溶液。
②氯化钠溶液能导电;乙醇溶液不能导电。
【猜想】铁的锈蚀速率与下列因素有关:
①反应时的温度;②氧气的含量;③水溶液的导电性。
【实验】每次取两套如图-13所示的装置,编号为I、II。向两套装置中分别装入质量、大小相同的铁钉和等体积的蒸馏水,进行如下三组对比实验(实验开始时,各瓶内气体压强保持一致)。
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II。 | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,_______。 |
| ②氧气含量 | _________。 | ________。 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇。 | 两套装置中铁钉均锈蚀; 且U型管中液面均由b处上升至a处,则所需时间I < II。 | _______。 |
| 影响因素 | 实验设计 | 实验现象 | 实验结论及解释 |
| ①温度 | 装置I放入25℃恒温环境中,装置II放入40℃恒温环境中。 | 两套装置中铁钉均锈蚀,且U型管中液面均由b处上升至a处,则所需时间I>II。 | 锈蚀的速率I<II;铁的锈蚀速率与反应时的温度有关,_______。 |
| ②氧气含量 | _________。 | ________。 | 铁的锈蚀速率与氧气的含量有关,氧气的含量越多,铁的锈蚀越快。 |
| ③水溶液的导电性 | 在相同温度下,装置I集气瓶中加入10mL氯化钠溶液;装置II集气瓶中加入10mL乙醇。 | 两套装置中铁钉均锈蚀; 且U型管中液面均由b处上升至a处,则所需时间I < II。 | _______。 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com