
题目列表(包括答案和解析)
(12分 )水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为_ __;
(2)写出与H2O分子互为等电子体的微粒____(填1种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_____
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
第 6 页 共 8 页
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____(请用相应的编号填写)
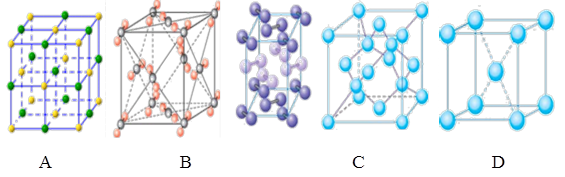
(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。
请写出生成此配合离子的离子方程式:___ 。
(12分 )水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为_ __;
(2)写出与H2O分子互为等电子体的微粒____(填1种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_____
| A.氧原子的杂化类型发生了改变 |
| B.微粒的形状发生了改变 第 6页 共 8页 |
| C.微粒的化学性质发生了改变 |
| D.微粒中的键角发生了改变 |

(12分 )水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)水分子中氧原子在基态时核外电子排布式为_ __;
(2)写出与H2O分子互为等电子体的微粒____(填1种)。
(3)水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+)。下列对上述过程的描述不合理的是_____
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
第 6 页 共 8 页
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(4)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是_____(请用相应的编号填写)

(5)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如图所示),已知冰的升华热是51 kJ/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是_________kJ/mol;
(6)将白色的无水CuSO4溶解于水中,溶液呈蓝色,是因为生成了一种呈蓝色的配合离子。
请写出生成此配合离子的离子方程式:___ 。
选择题
题号
1
2
3
4
5
6
7
8
答案
B
B
C
B
A
C
C
A
题号
9
10
11
12
13
14
15
16
答案
D
BC
AC
D
BC
A
A
C
17、(共8分、每空2分) (1)BD (2)碱式滴定管 (3)量筒 环形玻璃棒
18.(共20分)(1)浓盐酸的浓度随着反应的进行变稀以后,将不再反应(2分);加热时浓盐酸因挥发而损失(2分)
(2)① 无水硫酸铜(2分) 证明有水蒸气产生(2分)
白色变蓝色(其它合理答案也给分)(2分)②氯气无漂白性,次氯酸有漂白性 (2分)③吸收氯气(2分) ④Ag-+Cl-=AgCl↓(2分)
(3)F G(2分) 湿润的淀粉KI试纸(或湿润的有色布条)(2分)
19.(每空2分、共8分)(1)+1
(2)CuI 0.5
(3) 2 Cu2+
+ 5 I ―― 2 CuI + 1 I
―― 2 CuI + 1 I
20. (10分)
(1) Al2O3 ,Cl2
(2) 第三周期第ⅢA族
(3) Al(OH)3 + NaOH = NaAlO2 + 2H2O
(4)在常温下,铝的表面被浓硝酸钝化,生成一薄层致密、坚固的氧化物保护膜,从而阻止内部的金属继续与浓硝酸发生反应。所以铝不溶于冷的浓硝酸。
21、(10分)(1) (2分) 放热(2分)
(2分) 放热(2分)
(2)b、c (2分)
(3)不 (2分)
|