
题目列表(包括答案和解析)
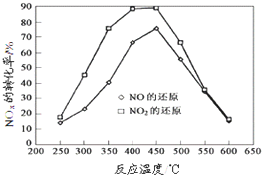 在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,
在一定条件下可用SnO2/Al2O3等多种催化剂实现丙烯选择性还原NOx,(12分)已知下列反应:
① N2(g)+3H2(g) 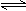 2NH3(g);ΔH=-92.4 kJ·mol-1。
2NH3(g);ΔH=-92.4 kJ·mol-1。
② 4NH3(g)+5O2(g)=====4NO(g)+6H2O(g);ΔH<0
(1)在500℃、2.02×107Pa和铁催化条件下向一密闭容器中充入1molN2和3molH2,充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是______________________________ ____;
(2)为有效提高氢气的转化率,理论上可采取的措施有__________;
| A.降低温度 | B.最适合催化剂活性的适当高温 | C.增大压强 | D.降低压强 |
 );
);
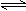 2NH3(g);ΔH=-92.4 kJ·mol-1。
2NH3(g);ΔH=-92.4 kJ·mol-1。| A.降低温度 | B.最适合催化剂活性的适当高温 | C.增大压强 | D.降低压强 |
 );
);
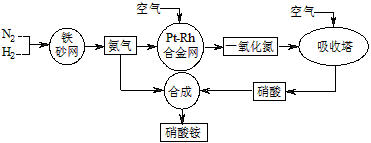
 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。 已知下列反应:
①N2(g)+3H2(g)![]() 2NH3(g);ΔH=-92.4 kJ·mol-1.
2NH3(g);ΔH=-92.4 kJ·mol-1.
②4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g);
4NO(g)+6H2O(g);
(1)
在500℃、2.02×107 Pa和铁催化条件下向一密闭容器中充入1 mol N2和3 mol H2,充分反应后,放出的热量________(填“<”“>”“=”)92.4 kJ,理由是________;(2)为有效提高氢气的转化率,理论上可采取的措施有________;
A.降低温度
B.最适合催化剂活性的适当高温
C.增大压强
D.降低压强
E.循环利用和不断补充氮气
F.及时移出氨
(3)反应②的化学平衡常数表达式K=________,温度降低时,K值________(填“增大”、“减小”或“无影响”);
(4)在0.5 L的密闭容器中,加入2.5 mol N2和7.5 mol H2,当该反应达到平衡时,测出平衡混合气的总物质的量为6 mol,则平衡时氮气的转化率=________
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com