25.钛已作为常用金属铁.铝后的第三金属.我国钛矿储量丰富.它的应用研究是目前科学研究的前沿之一. 2007年诺贝尔物理学奖为法国科学家阿尔贝.费尔和德国科学家彼得.格林贝格尔共同获得.以表彰他们在巨磁电阻效应研究方面的成就.某钙钛型复合氧化物.以A原子为晶胞顶点.A位可以是Ca.Sr.Ba或Pb.当B位是V.Cr.Ti.Fe时.这种化合物具有CMR效应.⑴写出该晶体的化学式 ⑵Ti的核外电子排布式为 它位于周期表中 区.价电子排布为 . 【
查看更多】
题目列表(包括答案和解析)
钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,对它的应用研究是目前科学研究的前沿之一。
(1)请写出铝原子的基态电子排布式:___________________。
(2)X+、Y-、Z-与Al3+具有相同的电子层结构,则下列说法正确的是___________。
A.元素第一电离能:X> Al
B.电负性:Z >Y
C.氢化物稳定性:H2Y>HZ
D.H2Y中Y的杂化类型是sp3,键角小于109°28'
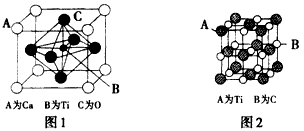
(3)某钙钛型复合氧化物如图1所示,以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有磁电阻效应。该钙钛型复合氧化物的化学式为________________
(4)最近发现钛(Ti)原子和碳原子可构成气态团簇分子,分子模型如图2。该气态团簇分子的分子式为
________,它属于_____晶体,其主要物理性质有____________、___________ (写出2点即可)。
查看答案和解析>>
钛已作为常用金属铁、铝后的第三金属,我国钛矿储量丰富,它的应用研究是目前科学研究的前沿之一。 2007年诺贝尔物理学奖为法国科学家阿尔贝。费尔和德国科学家彼得.格林贝格尔共同获得,以表彰他们在巨磁电阻效应(MR效应)研究方面的成就,某钙钛型复合氧化物(如右图),以A原子为晶胞顶点,A位可以是Ca、Sr、Ba或Pb,当B位是V、Cr、Ti、Fe时,这种化合物具有CMR效应。
⑴写出该晶体的化学式________________
⑵Ti的核外电子排布式为________它位于周期表中________区,价电子排布为________。
 ⑶锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)
⑶锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)
⑷最近发现钛(Ti)原子和碳原子构成气态团簇分子,分子模型如图。则其化学式为______。它属于______晶体,其主要物理性质____________ __________(写出2个即可)
查看答案和解析>>
钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用.但在较高温度下,钛可与多种单质和化合物发生反应.工业上冶炼钛主要以钛铁矿、金红石(含TiO
2大于96%)等为原料生产.
(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:

①沸腾氯化炉中反应:TiO
2(s)+2Cl
2 (g)=TiCl
4(l)+O
2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S=57.74J/K)
不能
不能
(选填:“能”或“不能”).
②已知:Ti(s)+2Cl
2(g)=TiCl
4(l)△H=-804.2kJ/mol;2Na(s)+Cl
2(g)=2NaCl(s)△H=-882.0kJ/mol;
Na(s)=Na(l)△H=2.6kJ/mol.
则TiCl
4(l)+4Na(l)=Ti(s)+4NaCl(s)△H=
-970.2
-970.2
kJ/mol
③海绵钛破碎后用0.5%~1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的
除去其中过量的钠并溶解氯化钠及钛的低价氯化物
除去其中过量的钠并溶解氯化钠及钛的低价氯化物
.
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺.试回答下列有关问题.
①TiO
2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,

阴极获得钛可能发生的反应或电极反应为:
TiO2+4e-=Ti+O2-
TiO2+4e-=Ti+O2-
.
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO
2污染物产生,通入的气体是
H2
H2
.
(3)海棉钛通常需要经过真空电弧炉里熔炼提纯,也可通过碘提纯法,原理为:

,下列说法正确的是
d
d
.
(a) 该反应正反应为的△H>0
(b) 在不同温度区域,TiI
4的量保持不变
(c) 在提纯过程中,I
2的量不断减少
(d) 在提纯过程中,I
2的作用是将粗钛从低温区转移到高温区.
查看答案和解析>>
钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用.但在较高温度下,钛可与多种单质和化合物发生反应.工业上冶炼钛主要以钛铁矿、金红石(含TiO
2大于96%)等为原料生产.
(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:

①沸腾氯化炉中反应:TiO
2(s)+2Cl
2 (g)=TiCl
4(l)+O
2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S=57.74J/K)______(选填:“能”或“不能”).
②已知:Ti(s)+2Cl
2(g)=TiCl
4(l)△H=-804.2kJ/mol;2Na(s)+Cl
2(g)=2NaCl(s)△H=-882.0kJ/mol;
Na(s)=Na(l)△H=2.6kJ/mol.
则TiCl
4(l)+4Na(l)=Ti(s)+4NaCl(s)△H=______kJ/mol
③海绵钛破碎后用0.5%~1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的______.
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺.试回答下列有关问题.
①TiO
2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,
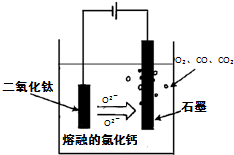
阴极获得钛可能发生的反应或电极反应为:______.
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO
2污染物产生,通入的气体是______.
(3)海棉钛通常需要经过真空电弧炉里熔炼提纯,也可通过碘提纯法,原理为:
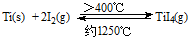
,下列说法正确的是______.
(a) 该反应正反应为的△H>0
(b) 在不同温度区域,TiI
4的量保持不变
(c) 在提纯过程中,I
2的量不断减少
(d) 在提纯过程中,I
2的作用是将粗钛从低温区转移到高温区.
查看答案和解析>>
钛是继铁、铝后的第三金属,常温下钛的化学活性很小,仅能与氟气、氢氟酸等几种物质起作用.但在较高温度下,钛可与多种单质和化合物发生反应.工业上冶炼钛主要以钛铁矿、金红石(含TiO
2大于96%)等为原料生产.
(1)由金红石为原料采用亨特(Hunter)法生产钛的流程如下:
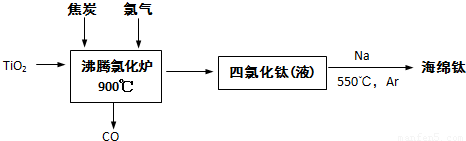
①沸腾氯化炉中反应:TiO
2(s)+2Cl
2 (g)=TiCl
4(l)+O
2(g),在常温下能否自发进行(已知该反应△H=184kJ/mol,△S=57.74J/K)______(选填:“能”或“不能”).
②已知:Ti(s)+2Cl
2(g)=TiCl
4(l)△H=-804.2kJ/mol;2Na(s)+Cl
2(g)=2NaCl(s)△H=-882.0kJ/mol;
Na(s)=Na(l)△H=2.6kJ/mol.
则TiCl
4(l)+4Na(l)=Ti(s)+4NaCl(s)△H=______kJ/mol
③海绵钛破碎后用0.5%~1.5%的盐酸洗涤,再用蒸馏水洗涤至中性,用盐酸洗涤的目的______.
(2)科学家从电解冶炼铝的工艺得到启发,找出了冶炼钛的新工艺.试回答下列有关问题.
①TiO
2直接电解法(剑桥法)生产钛是一种较先进的方法,电解质为熔融的氯化钙,原理如右图所示,阴极获得钛可能发生的反应或电极反应为:______.
②SOM技术是一种绿色环保先进技术,阳极用金属陶瓷,并用固体氧离子隔膜将两极产物隔开,阳极通入某种还原性气体,可防止CO、CO
2污染物产生,通入的气体是______.
(3)海棉钛通常需要经过真空电弧炉里熔炼提纯,也可通过碘提纯法,原理为:
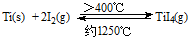
,下列说法正确的是______.
(a) 该反应正反应为的△H>0
(b) 在不同温度区域,TiI
4的量保持不变
(c) 在提纯过程中,I
2的量不断减少
(d) 在提纯过程中,I
2的作用是将粗钛从低温区转移到高温区.

查看答案和解析>>
第I卷
一、选择题
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
A
B
B
C
C
B
B
B
A
B
D
13.(8分)
(1)①非极性 二氧化碳电子式略。 (各1分)
② C(s) + O2(g) = CO2(g) △H =
-393.6kJ/mol 2分
(2) ① Al3+ + 4OH- = AlO2-
+ 2H2O
2分
② Al3+ + 3AlO2- + 6H2O =
4Al(OH)3↓ 2分
14.(10分)
. (1)1nm~100nm(1分)
(2)Fe FeS
H2SO4(稀)(3分)
(3)①H H(1分)
H(1分)
②2Fe2++H2O2+2H+=2Fe3++2H2O(2分)
(4)取少量E于试管中,用胶头滴管入NaOH溶液,加热试管,可观察到试管口处
湿润的红色石蕊试纸变蓝。(或其他合理答案)(3分)
15、(8分)
(1)K= (2分) 放热 (1分)
(2)b (1分) 1.5×10-3mol?L-1?s-1 (2分)
(3)bc (1分) (4)c (1分)
16、(10分)
方案一 (1) 保证NaHCO3全部分解 (1分)
方案二
(2)①检查装置的气密性(1分) 硫酸 (1分)
防止空气中水蒸气、CO2进入C管被吸收(1分)
② C (1分)
③需设计一将A、B中的CO2全部吹入C中吸收的气体装置(1分)
方案三
(3)①玻璃棒(1分)
②取少量滤液,再滴加BaCl2少许,如无白色沉淀说明沉淀完全(1分)
③ 51%(2分)
17.(18分)
(1)加成反应 (还原反应)(1分);
(2) CH3COOH 1分
 Br2CH― ―OOCCH3 ; 2分
Br2CH― ―OOCCH3 ; 2分
△
2分 ②
21.(10分) (1)加成反应 (还原反应)(2分);  (2)Br2CH― ―OOCCH3 ; CH3COOH (4分,各2分); (2)Br2CH― ―OOCCH3 ; CH3COOH (4分,各2分);
△ ②
(4分,各2分) 25、(11分) (1)CaTiO3((2分) (2)1S22S22P63S23P63d24S2或[Ar] 3d24S2 2分 d区 3d24S2 (各1分) (3)弱 1分 (4)Ti14C13 分子 熔点低、沸点低、硬度小(写出2个即可) (各1分) 29.答案.(1)蒸发结晶(或蒸发1分)
1,3,5 (1分) ②增加NH4+的浓度,有利于沉淀平衡向生成NH4Cl的方向进行,将NaHCO3转化为Na2CO3而不析出。(1分) (3)①HCl(或氯化氢)(1分) MgCl2?6H2O Mg(OH)Cl + HCl↑+5H2O(1分)
Mg(OH)Cl + HCl↑+5H2O(1分) (4)500 ; 3.8×1011C(各1分,共2分)
| | | | | |

 ⑶锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)
⑶锰的电负性为1.99。Cr的电负性为1.66,说明锰的金属性比铬_____(强、弱)
 阴极获得钛可能发生的反应或电极反应为:
阴极获得钛可能发生的反应或电极反应为: ,下列说法正确的是
,下列说法正确的是


 ,下列说法正确的是______.
,下列说法正确的是______.
 H(1分)
H(1分) Br2CH― ―OOCCH3 ; 2分
Br2CH― ―OOCCH3 ; 2分