
题目列表(包括答案和解析)
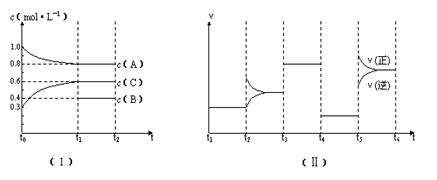
(6分)向一定体积的密闭容器中加入2molA、0.6molC和一定量的B三种气体。一定条件下发生反应,各物质的量浓度随时间变化如图(Ⅰ)所示,其中t0~t1阶段c(B)未画出。图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3~t4阶段为使用催化剂。
 |
请回答下列问题:
(1)若t1=15min,则t0~t1阶段以C物质的浓度变化表示的反应速率为 mol? L―1?min―1。
(2)t4~t5阶段改变的条件为 ,B的起始物质的量浓度为 mol? L―1。
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式 。
(10分).向一定体积的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体。一定条件下发生反应,各物质的量浓度随时间变化如图(Ⅰ)所示,其中t0--t1阶段c(B)未画出。图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化 的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3---t4阶段为使用催化剂。
的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3---t4阶段为使用催化剂。
请回答下列问题:
(1)若t1="15" min,则t0---t1阶段以C物质的浓度变化表示的反应速率为 mol·  L—1·min—1。
L—1·min—1。
(2)t4--t5阶段改变的条件为 ,B的起始物质的量浓度为 mol· L—1。
(3)t5----t6阶段保持容器内温度不变,若A的物质的量共变化了0.01mol,而此过程中的热效应为a kJ热量,写出此温度下该反应的热化学方程式

 的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3---t4阶段为使用催化剂。
的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3---t4阶段为使用催化剂。  L—1·min—1。
L—1·min—1。
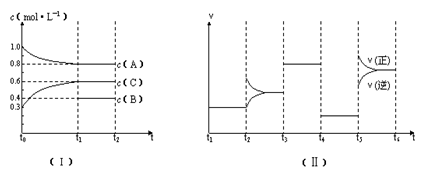
向一定体积的密闭容器中加入2 mol A、0.6 mol C和一定量的B三种气体.一定条件下发生反应,各物质的量浓度随时间变化如图(Ⅰ)所示,其中t0~t1阶段c(B)未画出.图(Ⅱ)为t2时刻后改变反应条件,化学反应速率随时间变化的情况,四个阶段改变的条件均不相同,每个阶段只改变浓度、压强、温度、催化剂中的一个条件,其中t3~t4阶段为使用催化剂.

请回答下列问题:
(1)若t1=15 min,则t0~t1阶段以C物质的浓度变化表示的反应速率为________mol·L-1·min-1.
(2)t4~t5阶段改变的条件为________,B的起始物质的量浓度为________mol·L-1.
(3)t5~t6阶段保持容器内温度不变,若A的物质的量共变化了0.01 mol,而此过程中容器与外界的热交换总量为a kJ,写出此温度下该反应的热化学方程式________.
| t1-t2 | t2-t3 | t3-t4 | t4-t5 | t5-t6 |
| K1 | K2 | K3 | K4 | K5 |
第Ⅰ卷
一、选择题
1―15 DBDCD BCBCA DBBCA
二、选择题
16.B 17.AD 18.CD 19.C 20.ABC 21.A 22.D
|