-理科综合(word版).files/image100.jpg)
运动的半径为-理科综合(word版).files/image102.gif) ………………(2分)
………………(2分)
微粒做圆周运动的向心力由洛伦兹力提供,即
-理科综合(word版).files/image104.gif)
解得-理科综合(word版).files/image106.gif) ……………………(3分)
……………………(3分)
(3)由图可知,磁场B2的最小区域应该分布在图示的矩形PACD内……………(2分)
由几何关系易得-理科综合(word版).files/image108.gif) ………………………(2分)
………………………(2分)
所以,所求磁场的最小面积为-理科综合(word版).files/image110.gif) …………(2分)
…………(2分)
26.(每空2分,共14分)
实验一:(1)生物体呼吸作用的耗氧量(或:生物体的呼吸强度)
(2)8(3)30因为只有整个系统生物群落的光合作用大于细胞呼吸,才能使水中保持一定的氧浓度
实验二:(1)进行有氧呼吸,消耗容器中O2,释放CO2,而CO2被容器中的碱液吸收
(2)有氧 容器中的氧不足以维持小麦种子的有氧呼吸,种子进行无氧呼吸不消耗O。,释放的CO2又被碱液吸收,容器中的压力不会改变
27.(除注明外每空2分,共19分)
(1)第一营养级鲢鱼
(2)提高生态系统抵抗力稳定性(或增强生态系统的自我调节能力)
(3)生态系统具有自我调节能力
(4)11.3%
(5)加0.3g尿素不加任何物质(或加0.3g蒸馏水)(注意乙和丁所加物质可互换)
①除去样品中原有的矿质元素
②丙(1分) 洗衣粉中含磷,尿素中含氮,营养充分,藻类生长繁殖快
28.(14分)(1)0.02mol/(L?min)(2分)
(2)升高温度(2分) 0.84(2分) K3=K4<K5(2分)
(3)2A(g)+B(g) 3C(g) △H=+200akJ/mol(2分)
(4)a+2c/3=2.4
b+c/3=1.2(4分)
29.(15分)(1)①湿润的红色石蕊(2分)
②碳酸 NH4HCO3 (NH4)2CO3和NH4HCO3的混合物(NH4)2CO3(各1分)
(2)①AB(2分)
②不合理(2分) 合理(2分)
③A、B、C(3分)
30.(13分)(1)第二周期、第VIIA族(2分)
(2)NaHSO4(2分) c(H+)>c(Na+)=c(SO42-)>c(OH-)(3分)
(3)1×10a-14mol/L(3分)
(4)CH4+10OH― ― 8e-=CO32-+7H2O(3分)
【选做部分】
31.(8分)(1)稀C1O2以防止爆炸(2分)
(2)2NaOH+2C1O2+H2O2=2NaC1O2+2H2O+O2(2分)
(3)测定吸收塔内溶液的pH(2分)
(4)蒸发、冷却结晶、过滤(2分)
32.(8分)(1)D的前一元素是P,P是3p能级为半充满状态的3p3,是稳定的结构;而S元素的3p能级3p4,是不稳定的结构。故P的第一电离能高于S(2分)
(2)2 2(各1分)
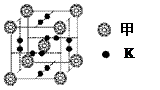
(3)MgSO4(2分) MgSO4的晶格能大于K2SO4的晶格能(2分)
-理科综合(word版).files/image112.jpg)
33.(8分)(1) (2) (3)X;加成反应或还原反应 Y:消去反应(各1分)
浓硫酸 △ (4)CH3CH2COOH+CH3OH CH3CH2COOCH3+H2O(2分) 34.(每空1分,共8分)(1)氮源 无机盐 中性或微碱性 (2)植物激素 (3)热稳定性 一次性 (4)血红蛋白的释放 凝胶色谱柱的填充 35.(每空1分,共8分)(1)荧光素酶基因 启动子、终止子和标记基因 (2)C (3)A、D (4)CaC12(或Ca2+)农杆菌转化 (5)目的明确 培育周期短 可以克服远缘杂交的不亲和性(只要合理,两点即得分) 36.(8分)(1)B(2分) (2)①由理想气体的状态方程-理科综合(word版).files/image114.gif) 得气体在状态B的温度-理科综合(word版).files/image116.gif) ………………2分 ………………2分 ②由状态B→C,气体做等容变化,由查理定律得: -理科综合(word版).files/image118.gif) …………1分 …………1分
故气体由B到C为等容变化,不做功,但温度降低,内能减小。根据热力学第一定律, -理科综合(word版).files/image120.gif) ,可知气体要放热 (3分) ,可知气体要放热 (3分)
37.(8分) 解析:(1)CD(3分,全对3分,选对但不全的1分,有错0分)
-理科综合(word版).files/image122.jpg)
由-理科综合(word版).files/image124.gif) 得 得-理科综合(word版).files/image126.gif) ………………(2分) ②-理科综合(word版).files/image128.gif) ………………(1分) 光线射到BC界面的入射角为-理科综合(word版).files/image130.gif) °―(180°―60°―75°)=45°。 °―(180°―60°―75°)=45°。 所以发射全反射…………………………1分 光线沿DE方向射出棱镜时不改变方向,故此束光线射出棱镜后方向与AC界面垂直…………………………2分 38.(8分) 解析: (1)聚变的核反应方程:-理科综合(word版).files/image132.gif) ……………………(2分) ……………………(2分) 核反应过程中的质量亏损为-理科综合(word版).files/image134.gif) 释放的核能为-理科综合(word版).files/image136.gif) …………(2分) …………(2分) (2)对撞过程动量守恒,由于反应前两氘核动能相同,其动量等值反向,因此反应前后系统的动量为0,即-理科综合(word版).files/image138.gif) …………………………(1分) …………………………(1分) 反应前后总能量守恒,即-理科综合(word版).files/image140.gif) …………(1分) …………(1分) 解得-理科综合(word版).files/image142.gif) ……………………(2分) ……………………(2分)
| | | | | |

 (2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
(2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则: Z的水溶液中所有离子的浓度由大到小的顺序为 ;
Z的水溶液中所有离子的浓度由大到小的顺序为 ;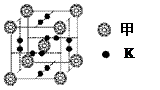 (2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则:
(2)若D是地壳中含量位居第二的元素,其单质是制造太阳能电池板的关键材料,其氧化物在数据传输方面贡献突出,则: Z的水溶液中所有离子的浓度由大到小的顺序为 ;
Z的水溶液中所有离子的浓度由大到小的顺序为 ;