
题目列表(包括答案和解析)
使反应4NH3(g)+ 3O2(g) = 2N2(g) + 6H2O(g)在2L的密闭容器中进行,半分钟后N2的物质的量增加了O.6mol。此反应的平均速率v(X)为
A. v(NH3)=0.04mol·L-1·s-1 B. v(O2)=0.01mol·L-1·s-1
C. v(N2)=0.02mol·L-1·s-1 D. v(H2O)=0.03mol·L-1·s-1
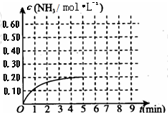 (2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=
(2010?烟台一模)某温度时,在一容积为1L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,5min时达到平衡,反应中NH3的物质的量浓度的变化情况如图所示:请回答下列问题:(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=| c(NH3)2 |
| c(N2).c(H2)3 |
| c(NH3)2 |
| c(N2).c(H2)3 |
| A、v(NH3)═0.04mol?L-1?s-1 | B、v(O2)═0.015mol?L-1?s-1 | C、v(N2)═0.02mol?L-1?s-1 | D、v(H2O)═0.02mol?L-1?s-1 |
| A、v(NH3)=0.02mol?L-1?s-1 | B、v(O2)=0.01mol?L-1?s-1 | C、v(N2)=0.02mol?L-1?s-1 | D、v(H2O)=0.02mol?L-1?s-1 |
在四个不同的容器中,在不同的条件下进行合成氨的反应。根据下列在相同时间内测定的结果判断生成氨气的速率最大的是 ( )
A.v(H2)=0.1mol?L-1?min-1 B.v(N2)=0.1mol?L-1?min-1
C.v(N2)=0.2mol?L-1?min-1 D.v(NH3)=0.3mol?L-1?min-1
一、 单项选做题(本大题共23题,每题3分,共69分。)
题号
1
2
3
4
5
6
7
8
9
10
11
12
答案
A
C
D
C
B
C
C
A
A
B
C
B
题号
13
14
15
16
17
18
19
20
21
22
23
答案
D
A
A
D
C
A
B
C
D
B
D
24、A.《化学与生活》
1)(5分)油脂、淀粉、蛋白质是三种重要的营养成分,其中 油脂 不是高分子化合物,它们都能发生 水解_反应,淀粉的最终产物是(写化学式) C6H12O6,蛋白质的最终产物是 氨基酸 ,提纯蛋白质可以用的方法是 盐析 。
2)(5分)正常雨水PH为 5.6 ,这是因为 二氧化碳溶于其中 的缘故;酸雨是指 PH<5.6 的降水,我国主要以 硫酸 型酸雨为主,是由我国以 煤 为主的能源结构造成的。
3)(5分)(1)每年世界上钢铁的产量很高,但钢铁的腐蚀也给人类带来了巨大的损失,铁在潮湿的空气中锈蚀主要属于电化学腐蚀,其负极的电极反应为Fe - 2e- = Fe2+,并写出两种不同类型的防腐的方法 涂油漆 、 采用不锈钢 。(合理均给分,每空1分)
(2)铝的活动性比铁强,但铝在空气中却比铁表现出良好的抗腐蚀性,其原因是铝表面形成的致密的氧化膜 。(2分)
25、(6分)(1)写出下列物质的化学式:B Cl
(2)写出D和E分别与A反应的离子方程式:
D+A: 2 Fe3+ + Fe = 3Fe2+ (2分)
E+A: Fe + 2H+ = Fe2+ + H2 ↑ (2分)
26、(10分)
【问题一】与藻类疯长的密切相关的元素是 P 和 N 。(填元素符号)
【问题二】海水中资源丰富,含量最多的金属阳离子是 Na+ (填符号),含量最多的分子是 H2O (填分子式)。
|