
题目列表(包括答案和解析)
(16分) (1)①向NaHCO3溶液中,逐滴加入Ca(OH)2溶液至过量,请写出发生反应的离子方程式: 。
②在Fe(NO3)2溶液中,滴加盐酸,溶液变黄并产生无色气体,请写出反应的离子方程式:
(2)将一小块钠投入水中,观察到:钠浮于水面,说明 ;钠熔成小球,说明 ;钠四处游动并发出嘶嘶的响声,说明 ;将钠投入酒精中与投入水中所发生的现象不同点有_____________________________________ ,酒精与水相比, 更难电离。
(3)已知:酚酞在c(OH-)为1.0×10-4mol/L~2.5mol/L时呈红色,且0.5min内不会褪色; H2O2具有氧化性和漂白性。
将3.9g过氧化钠放入烧杯中,加入100mLH2O,充分反应后取上述溶液于试管中,滴入2滴酚酞试液,溶液变红,片刻红色褪去。
① 有人认为“红色迅速褪去”是由于溶液中c(OH-)过大造成的,试通过估算并对比数据加以说明。
② 还有人认为“红色迅速褪去”是因为溶液中存在H2O2。试设计实验证明烧瓶内的溶液中可能含有H2O2存在,请简述实验操作
。
③ 补充实验,证明“红色迅速褪去”与溶液中存在H2O2有关,请简述实验操作 如图是制取溴苯的装置.试回答:
如图是制取溴苯的装置.试回答:| 溴化铁 |
| 溴化铁 |
实验室中所用少量氯气用下列装置制取:
 |
试回答下列问题:
(1)写出该反应的离子方程式 。在该氧化还原反应中, HCl的作用是 。
(2)集气瓶B中盛装的是 。
(3)集气瓶C中盛装的是FeCl2溶液。实验开始后,C中反应的离子方程式为
。实验室中可用 检验反应生成的阳离子。在实验室也可用此反应的生成物来制备氢氧化铁胶体,请写出相应的化学方程式 。
(4)集气瓶D中盛装的是水,E装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出 E中反应的化学方程式 。
(5)在F处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
。
(6)若将F处的烧杯中的溶液改为澄清的石灰水,反应过程中的现象为 (选填标号)。
A.有白色沉淀 B.无现象 C.先生成白色沉淀而后消失
(7)氯气尾气直接排入大气中,会污染环境。实验室中可采用 来吸收有毒的氯气。该反应的离子方程式为 。
实验室中所用少量氯气用下列装置制取:
 |
试回答下列问题:
(1)写出该反应的离子方程式 。在该氧化还原反应中, HCl的作用是 。
(2)集气瓶B中盛装的是 。
(3)集气瓶C中盛装的是FeCl2溶液。实验开始后,C中反应的离子方程式为
。实验室中可用 检验反应生成的阳离子。在实验室也可用此反应的生成物来制备氢氧化铁胶体,请写出相应的化学方程式 。
(4)集气瓶D中盛装的是水,E装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为二氧化碳和氯化氢,写出 E中反应的化学方程式 。
(5)在F处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是
。
(6)若将F处的烧杯中的溶液改为澄清的石灰水,反应过程中的现象为 (选填标号)。
A.有白色沉淀 B.无现象 C.先生成白色沉淀而后消失
(7)氯气尾气直接排入大气中,会污染环境。实验室中可采用 来吸收有毒的氯气。该反应的离子方程式为 。
某课外活动小组设计如图所示装置,进行氯气的制备及有关性质实验.
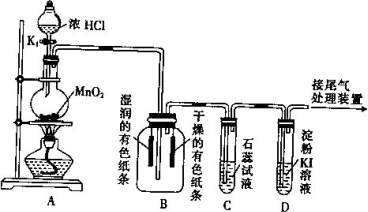
(1)装置A中发生反应的离子方程式为________.
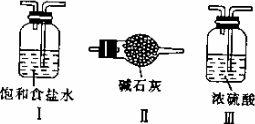
(2)上述装置中明显存在不足之处,为保证装置B中实验成功,应在装置A、B之间添加一个装置,该装置是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”)
(3)装置C中溶液发生的颜色变化为:
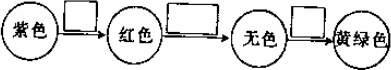
请在方框内填写出导致该阶段颜色变化的化学符号.
(4)装置D中起始的实验现象是________________.
(5)实验结束后,对装置A的烧瓶中残存气体的处理方法是________________.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com