
题目列表(包括答案和解析)
电解原理常应用于工业生产
(1)火法炼铜得到的粗铜中含多种杂质(如锌、金、银等),其性能远不能达到电气工业的要求,工业上常使用电解精炼法将粗铜提纯。在电解精炼时,粗铜接电源 极,电极反应为 ;纯铜作 极,电极反应为 。
(2)工业上用电解饱和食盐水的方法可制得烧碱、氯气、氢气。电解时,总反应化学方程式为 ;电解时所需的精制食盐水,通常在粗盐水中加入某些试剂来除去其中的Ca2+、Mg2+、Fe3+、SO42-杂质离子,添加试剂的先后顺序 (填所加试剂的化学式)。
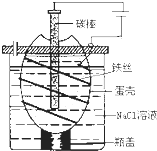
(3)为了避免产物相混合发生副反应,工业上采用离子交换膜法电解食盐水。下图为阳离子交换膜法电解饱和食盐水原理示意图。电极反应为:

阳极 ,
阴极 。
下列说法中正确的是
A.从E口逸出的气体是H2
B.从B中加入含少量NaOH的水溶液以增强导电性
C.标准状况下每生成22.4L Cl2,便产生2molNaOH
D.向电解后的阳极室溶液中加适量盐酸,可以恢复到电解前的物质的浓度
下列关于电解的说法中,不正确的是( )
A.工业电解饱和食盐水用于生产氢氧化钠和氯气
B.不能自发进行的氧化还原反应,通过电解的原理可以实现
C.粗铜中所含的Ni、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥
D.在铁制品上镀一定厚度的银层,银作阳极,铁制品作阴极,溶液中含有银离子
|
下列关于电解的说法中,不正确的是 | |
| [ ] | |
A. |
工业电解饱和食盐水用于生产氢氧化钠和氯气 |
B. |
不能自发进行的氧化还原反应,通过电解的原理可以实现 |
C. |
粗铜中所含的Ni、Fe、Zn等杂质,电解后以单质形式沉积槽底,形成阳极泥 |
D. |
在铁制品上镀一定厚度的银层,银作阳极,铁制品作阴极,溶液中含有银离子 |
(1)将饱和氯化铁溶液滴入沸水,煮沸至液体呈红褐色停止加热,反应的离子方程式是:
_____________ _________。将此液体装入U形管内,用石墨做电极,接通直流电,通电一段时间后发现 (填阳极或者阴极)附近的颜色加深。
(2)下列实验设计或操作合理的是_____ ___。
A.在催化剂存在的条件下,苯和溴水发生反应可生成比水重的溴苯
B.只用水就能鉴别苯、硝基苯、乙醇
C.实验室制取乙烯时必须将温度计的水银球插入反应液中,测定反应液的温度
D.将10滴溴乙烷加入1mL 10%的烧碱溶液中加热片刻后,再滴加2滴2%的硝酸银溶液,以检验水解生成的溴离子
E.工业酒精制取无水酒精时先加生石灰然后蒸馏,蒸馏必须将温度计的水银球插入反应液中,测定反应液的温度
F.苯酚中滴加少量的稀溴水,可用来定量检验苯酚
G.将铜丝弯成螺旋状,在酒精灯上加热变黑后,立即伸入盛有无水乙醇的试管中,完成乙醇氧化为乙醛的实验
H.为了减缓电石和水的反应速率,可用饱和食盐水来代替水进行实验
 工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
工业上通过电解饱和氯化钠溶液的方法获得氢氧化钠和氯气,图为某实验小组自制的电解饱和食盐水的简易装置,
| ||
| ||
1
2
3
4
5
6
7
8
9
10
11
B
C
D
D
A
D
A
D
C
B
A
12
13
14
15
16
17
18
19
20
21
D
C
A
ABD
AD
BD
BC
D
ABC
A
22、参考答案∶
(1)CD ??????4分,选的不全得2分
(2)①3000;??????3分
② B;?????? 3 分
③ 闭合开关S1,读出电压表的示数U1,再闭合S2,读出电压表的示数U2;
??????4分,少说一个步骤得2分
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image078.gif) ??????4分
??????4分
23、参考答案∶16分
H=gt12/2 ??????3分
S1=v0?t1 ??????3分
a=μmg/m ??????3分
v0=at2 因为t2小于t1,所以B先停下。 ??????3分(没有说明的不给这三分)
v02=2as2 ??????3分
△s=s1-s2=
24、参考答案∶ 19分
(1)S=2Rn+R ??????2分
qvB=mv2/R ??????2分
v=Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image080.gif) ??????2分
??????2分
(2)T=2πR/v=2πm/qB ??????2分
t1=nT/2+T/4 ??????2分
t1=Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image082.gif) ??????2分
??????2分
在电场中:
a=qE/m ??????2分
v=n at2/2 ??????2分
t2=Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image084.gif) ??????2分
??????2分
t=t1+t2=Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image086.gif) 式中n取0、1、2、3 …… 1分 (不说明n不给分)
式中n取0、1、2、3 …… 1分 (不说明n不给分)
25、参考答案∶ 19分
VA=SOP/t ??????2分
vB=4SOP/t ??????2分
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image088.gif) ??????4分
??????4分
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image090.gif) ??????4分
??????4分
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image092.gif)
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image094.gif)
vB=-4vA ??????4分
mA:mB=2:3 ??????3分
26.(16分)(1)S H(各1分)(2)N2+3H2 Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image005.gif) 2NH3 (注意条件) (2分)
2NH3 (注意条件) (2分)
液氨汽化要吸收大量的热(2分) NH3 > H2S(2分)
(3)NH4NO3 (1分) 酸性(1分) NH4++H2OWord版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image005.gif) NH3H2O+H+(1分)
NH3H2O+H+(1分)
c(NO3-)>c(NH4+)>c(H+)>c(OH-)(2分) 1014
(4)SO2 (1分) 酸雨(1分)
27.(13分)(1)离子键,非极性键(或共价键)(2分), Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image096.jpg) (2分)
(2分)
(2)高温、常压、催化剂(2分)
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image097.gif) (3)Fe2O3+6H+ 2Fe3++3H2O
(2分)
(3)Fe2O3+6H+ 2Fe3++3H2O
(2分)
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image097.gif) Fe2(SO4)3+6NaOH 2Fe(OH)3
↓ +3Na2SO4
(2分)
Fe2(SO4)3+6NaOH 2Fe(OH)3
↓ +3Na2SO4
(2分)
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image098.gif) (4)FeS2(s)+
(4)FeS2(s)+Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image100.gif) O2(g)
O2(g) Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image102.gif) Fe2O3(s)+2SO2(g);△H=-852kJ/mol (3分)
Fe2O3(s)+2SO2(g);△H=-852kJ/mol (3分)
28.(15分)
Word版2009.03/黑龙江省哈六中2009届高三第一次模拟考试(理综)Word版.files/image104.jpg)
29.(16分) (1) 棉花团变蓝,刚加热时A中导管有气泡冒出,一会儿停,无浑浊出现,B中持续出现气泡,溶液变白色浑浊 (2分 )
(2) 防止倒吸(或先移出石灰水中导管) 。(2分 )
(3) Na2CO3热稳定性大于NaHCO3 ,NaHCO3受热分解有CO2和H2O生成(2分 )
(4) B 、C (2分 )
|