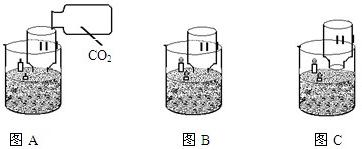
32、如图A所示,取一个大烧杯,在里面装入约1/2的细沙;烧杯一边的细沙中,插入高低不同的两支蜡烛;将截取瓶底的大口饮料瓶做成简易漏斗,取三张用石蕊溶液染成紫色的干燥小纸条,将一张干燥的和一张润湿后的纸条(润湿后仍为紫色)粘在简易漏斗的内壁,将另一张纸条润湿后,粘在简易漏斗的外壁,将漏斗插入细沙的另一边.按下列各步骤继续实验,并回答有关问题.
(1)如图A,用以收集满二氧化碳的集气瓶(集气瓶的容积与简易漏斗内容积相当)向漏斗内慢慢倒入体,可以观察到的实验现象是
C
(填字母);
A.漏斗内干燥的纸条变成红色,漏斗内、外壁湿润的纸条都不变色
B.漏斗外壁上湿润的纸条变成红色,漏斗内干燥及湿润的纸条都不变色
C.漏斗内壁上湿润的纸条变成红色,漏斗内干燥的纸条和外壁湿润的纸条都不变色
由此现象能够得出的结论是
水和二氧化碳都不能使紫色石蕊变成红色,二氧化碳与水反应的生成物(碳酸)能使紫色石蕊溶液变成红色
.
(2)如图B所示,快速点燃两支蜡烛.
(3)如图C所示,将漏斗向上慢慢提起至下端高于烧杯口,可以观察到的实验现象是
低蜡烛先熄灭,随后高处的蜡烛熄灭
,根据此现象能够得出的结论是
二氧化碳密度比空气大,不可燃也不支持燃烧
.

 32、如图A所示,取一个大烧杯,在里面装入约1/2的细沙;烧杯一边的细沙中,插入高低不同的两支蜡烛;将截取瓶底的大口饮料瓶做成简易漏斗,取三张用石蕊溶液染成紫色的干燥小纸条,将一张干燥的和一张润湿后的纸条(润湿后仍为紫色)粘在简易漏斗的内壁,将另一张纸条润湿后,粘在简易漏斗的外壁,将漏斗插入细沙的另一边.按下列各步骤继续实验,并回答有关问题.
32、如图A所示,取一个大烧杯,在里面装入约1/2的细沙;烧杯一边的细沙中,插入高低不同的两支蜡烛;将截取瓶底的大口饮料瓶做成简易漏斗,取三张用石蕊溶液染成紫色的干燥小纸条,将一张干燥的和一张润湿后的纸条(润湿后仍为紫色)粘在简易漏斗的内壁,将另一张纸条润湿后,粘在简易漏斗的外壁,将漏斗插入细沙的另一边.按下列各步骤继续实验,并回答有关问题.