
题目列表(包括答案和解析)
Ⅰ.反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X.
(1)已知K2S在反应中失去电子,则该反应的氧化剂是________.
(2)已知0.5 mol K2S在反应中失去1 mol电子生成X,则X的化学式为________.
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目:
(4)若反应中浓H2SO4过量,则________产物中无X生成,请完成此化学反应方程式:________.
Ⅱ.短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1∶1的离子化合物A,X与Z能形成原子个数比为1∶1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
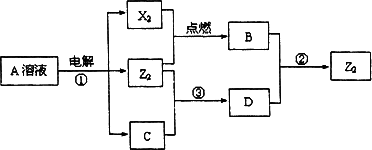
(1)Y在周期表的位置是________;
(2)反应①的化学方程式是________.
(3)D溶液呈碱性的原因是(用离子方程式表示)________.
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应.某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去).
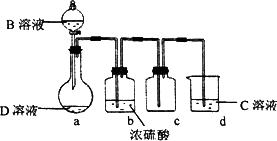
(4)写出反应②的离子方程式________.
(5)上述实验装置不够完善,改进方法是________.
(14分)Ⅰ.反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X。
(1)已知K2S在反应中失去电子,则该反应的氧化剂是 。
(2)已知0.5molK2S在反应中失去1mol电子生成X,则X的化学式为 。
(3)将氧化剂和还原剂及其配平后系数填入下列空格中,并标出电子转移的方向和数目:
![]()
(4)若反应中浓H2SO4过量,则 产物中无X生成,请完成此化学反应方程式: 。
Ⅱ.短周期元素X、Y、Z的原子序数依次增大,X和Y同主族,Y和Z同周期,Y与Z能形成离子个数比为1﹕1的离子化合物A,X与Z能形成原子个数比为1﹕1的共价化合物B,它们之间能实现如图所示转化(部分产物已略去):
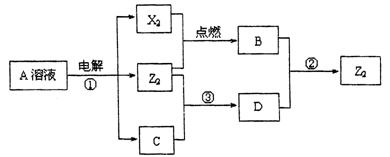
(1)Y在周期表的位置是 ;
(2)反应①的化学方程式是 。
(3)D溶液呈碱性的原因是(用离子方程式表示) 。
D是很多漂白剂中含有的有效成分,这些产品不能与洁厕灵(含有有机酸和无机酸)一起使用,其原因就是在常温时能发生与反应②相似的反应。某校的学生在实验室利用反应②的原理来制备纯净、干燥的Z2,仪器装置如图所示(夹持固定装置的仪器已略去)。
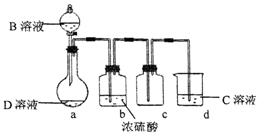
(4)写出反应②的离子方程式 。
(5)上述实验装置不够完善,改进方法是 。
溶液中的离子之间如能发生反应,则在溶液中不能大量共存.下列离子在溶液中能大量共存的是
[ ]
A. 、
、 、
、 、
、
B. 、
、 、
、 、
、
C. 、
、 、
、 、
、
D. 、
、 、
、 、
、
溶液中的离子之间如能发生反应,则在溶液中不能大量共存.下列离子在溶液中能大量共存的是
[ ]
A. 、
、 、
、 、
、
B. 、
、 、
、 、
、
C. 、
、 、
、 、
、
D. 、
、 、
、 、
、
(11分)利用燃料和氧化剂之间发生的氧化还原反应,将化学能直接转化为电能的装置叫燃料电池,它是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是甲烷、甲醇、肼、氨等。肼分子(H2N-NH2)可以在氧气中燃烧生成氮气和水,回答下列问题:
(1)利用肼、氧气与KOH溶液组成碱性燃料电池,请写出该电池负极的电极反应式:
,并指出电解质溶液中OH-离子向 极移动。
若用该燃料电池电解饱和食盐水得C12 7.1g,则需肼 g,若想将电解后饱和食盐水恢复原状,需 。
(2)用电离方程式表示肼的水溶液呈碱性的原因 ;
(3)天然气有着来源广,污染小的优点,但未能在汽车燃料中推广应用,而其催化氧化产物甲醇却被推广使用,主要是因为 。
(4)如果将燃料改为汽油则为汽油燃料电池,该燃料电池最大的障碍是氧化反应不完全产生 堵塞电极的气体通道,有人估计,完全避免这种副反应至少还需10年时间,正是新一代化学家的历史使命。
(5)肼是强还原剂,与氧化剂H2O2反应时可放出大量的热,因此,肼可以作为火箭推进剂。
某些共价键的键能
键 | 键能/kJ?mol-1 | 键 | 键能/kJ?mol-1 | 键 | 键能/kJ?mol-1 |
N-N | 193 | N=N | 418 | N≡N | 946 |
O-O | 142 | O=O | 497 | H-H | 436 |
N-H | 391 | O-H | 463 |
|
|
根据以上信息,试写出肼与H2O2反应的热化学方程式 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com