
题目列表(包括答案和解析)
(12分) (1)某温度下,Kw=10-12。
①若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显 性(填“酸”、“碱”或“中”)。
②若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(H+)= mol·L-1。
(2)常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②混合溶液中离子浓度由大到小的顺序是: 。
③混合溶液中由水电离出的c(H+) 同浓度NaOH溶液中由水电离出的c(H+)
(填“>”、“<”或“=”)。
④求出混合溶液中下列算式的精确计算结果(填具体数据):
c(Na+)-c(A-)= mol/L。
(12分) (1)某温度下,Kw=10-12。
①若保持温度不变,某溶液中c(H+)为1×10-7mol·L-1,则该溶液显 性(填“酸”、“碱”或“中”)。
②若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH-)=1010,则此时水电离的c(H+)= mol·L-1。
(2)常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
①混合溶液的pH=8的原因(用离子方程式表示): 。
②混合溶液中离子浓度由大到小的顺序是: 。
③混合溶液中由水电离出的c(H+) 同浓度NaOH溶液中由水电离出的c(H+)
(填“>”、“<”或“=”)。
④求出混合溶液中下列算式的精确计算结果(填具体数据):
c(Na+)-c(A-)= mol/L。
(12分)如图所示,组成一种原电池。试回答下列问题(灯泡功率合适):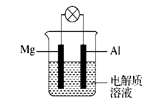
(1)电解质溶液为稀H2SO4时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Mg为原电池的 极;若灯泡不亮,其理由为 。
(2)电解质溶液为NaOH溶液时,灯泡 (填“亮”或“不亮”)。若灯泡亮,则Al做原电池的 极。若灯泡不亮,其理由为 。
(3) 铝的阳极氧化,是一种常用的金属表面处理技术,它能使铝的表面生成一层致密的氧化膜,该氧化膜不溶于稀硫酸。某化学研究小组在实验室中按下列步骤模拟该生产过程。
按图取两片质量相当的铝片组装好仪器,接通开关K,通电约25 min。在阳极生成氧化铝,阴极产生气体。写出该过程中的阳极反应式:______________________________。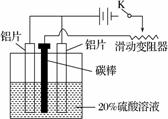
如果此时取出两极,用蒸馏水洗净,晾干后称重发现两个电极质量差为0.8克,计算阴极产物在标准状态下的体积并写出计算过程。
(12分每空两分)某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
| A.用酸式滴定管量取20.00mLHCl溶液注入锥形瓶,同时滴加2-3滴酚酞试液; |
| B.用0.10 mol/L的HCl溶液润洗酸式滴定管; |
| C.把滴定管用蒸馏水洗净; |
| D.取下碱式滴定管,用待测NaOH溶液润洗后,将待测NaOH溶液注入碱式滴定管至距离刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面; |
 。
。(12分 每空两分)某同学用0.10 mol/L的HCl溶液测定未知浓度的NaOH溶液,其实验操作如下:
A.用酸式滴定管量取20.00mLHCl溶液注入锥形瓶,同时滴加2-3滴酚酞试液;
B.用0.10 mol/L的HCl溶液润洗酸式滴定管;
C.把滴定管用蒸馏水洗净;
D.取下碱式滴定管,用待测NaOH溶液润洗后,将待测NaOH溶液注入碱式滴定管至距离刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面;
E.检查滴定管是否漏水;
F.另取锥形瓶,再重复以上操作1—2 次;
G.把锥形瓶放在碱式滴定管下边,瓶下垫一张白纸,边滴边摇动锥形瓶,直到加入l滴碱液后溶液颜色突变并在半分钟内不再变色为止,记下滴定管液面所在的刻度。请回答下列问题:
(1)(2分)滴定操作的正确顺序是:(填字母)
→C→ →B→
→ → __ 。
。
(1) G步操作中在锥形瓶下垫一张白纸是的作用是 。
(3)D步操作中液面应调节到 ,尖嘴部分应 。
(4)滴定终点读数时,如果仰视液面,读出的数值 ,若滴定前平视读数则由此计算得到的NaOH溶液浓度 。(填“偏大”、“偏小”、“无影响”)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com