(2011?朝阳区二模)已知甲、乙、丙均为常见气体,其中甲在空气中含量最多,乙在相同条件下密度最小,丙有刺激性气味,且一个丙分子由四个原子构成.
(1)实验室中可用下图A或B装置与相应的药品制得丙.
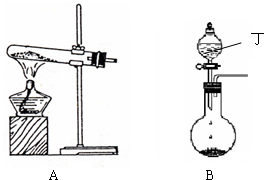
①A中试管内反应的化学方程式是
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
.
②B中分液漏斗内盛放的物质丁是
浓氨水
浓氨水
,圆底烧瓶内的物质是
氧化钙(氢氧化钠或碱石灰)
氧化钙(氢氧化钠或碱石灰)
.(均填名称)
(2)工业上将甲和乙在高温、高压、催化剂的条件下制取丙.下图是甲和乙反应过程中能量变化图:
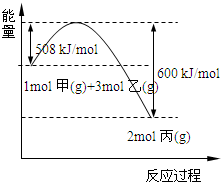
该反应的热化学方程式是
N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol
N2(g)+3H2(g)?2NH3(g);△H=-92kJ/mol
.
(3)丙在氧气中燃烧的反应是置换反应,该反应的化学方程式是
.
(4)①将丙和CO
2气体通入饱和食盐水中有碳酸氢钠晶体析出,反应的离子方程式是
NH3+CO2+H2O+Na+=NaHCO3↓+NH4+
NH3+CO2+H2O+Na+=NaHCO3↓+NH4+
.
②为了验证上述晶体既不是NH
4HCO
3、也不是NaCl而是NaHCO
3,设计实验方案如下,完成下列部分实验报告:
| 实验操作 |
实验现象 |
结论 |
相应的离子方程式 |
| 取少量晶体于试管中,充分加热 |
试管内有固体剩余 |
该晶体不是NH4HCO3 该晶体不是NH4HCO3 |
无离子方程式 无离子方程式 |
向冷却后试管中加入足量盐酸 向冷却后试管中加入足量盐酸 |
固体全部溶解,有气泡产生 |
该晶体不是NaCl是NaHCO3 该晶体不是NaCl是NaHCO3 |
CO32-+2H+=H2O+CO2↑ CO32-+2H+=H2O+CO2↑ |
(5)若用(1)中得A制取丙,并用园底烧瓶通过排气法收集丙(标准状况),然后进行喷泉实验.当水进入到烧瓶体积得3/5时,液面不再上升,此时立即关闭止水夹,烧瓶内溶液中溶质的物质的量浓度是
0.0045
0.0045
mol/L(精确到0.001).



 下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液
下列物质 ①Cu ②液态SO2 ③纯醋酸 ④NaHCO3 ⑤Ba(OH)2溶液 H2CO3+OH-
H2CO3+OH- H2CO3+OH-
H2CO3+OH-