
题目列表(包括答案和解析)
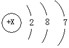 ;则x =____。根据元素原子结构示意图,不能直接获得的信息是__(填编号)。
;则x =____。根据元素原子结构示意图,不能直接获得的信息是__(填编号)。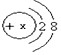 ,若X等于11,则该微粒表示______(填“阳” 或“阴”)离子。在N、N2、2N2三种符号中,只表示微观意义,而不表示宏观意义的是___________。
,若X等于11,则该微粒表示______(填“阳” 或“阴”)离子。在N、N2、2N2三种符号中,只表示微观意义,而不表示宏观意义的是___________。 ,若X 等于11 ,则该微粒表示_________ (填“原子”、“阳离子”、“阴离子”)。
,若X 等于11 ,则该微粒表示_________ (填“原子”、“阳离子”、“阴离子”)。 根据题意填写下列空格:
(1)某微粒的结构示意图为 ![]() ,若X等于11,则该微粒表示_____???___(填“阳”
,若X等于11,则该微粒表示_____???___(填“阳”
或“阴”)离子。在N、N2、2N2三种符号中,只表示微观意义,而不表示宏观意义的是
(2)构成物质的基本微粒有分子、原子、离子。氯化钠是由 构成的;水是由 构成的;金(Au)是由 构成的。
(3)有下列物质:CO2 、CO 、H2 、CH4 ,其中通入紫色石蕊溶液,溶液变红的是___________, 最理想的燃料是_____???_____,属于有机物的是_____???_____。
(4)加钙牛奶中的“钙”是指 (填“元素”或“原子”),身体中一旦缺钙,可能患
有的疾病是 (填“骨质疏松”或“贫血”)。
(5)通过晾晒海水或煮盐井水、盐湖水等方法,均可得到含有较多杂质的粗盐,这种方
法属于__________变化(填“物理”或“化学”)。粗盐经过__________、过滤、__________
可得到初步提纯,再通过化学方法获得精盐。
(6)某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
①计算:氯化钠的质量为 g,水为 g。
②称量:用托盘天平称量,氯化钠应放在 (填“左盘”或“右盘”)。
③溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是 (从下列中选用:10mL、25 mL、50 mL、100 mL)。量取液体时,量筒必须放平,视线与液体的_________ 保持水平。溶解氯化钠要用到玻璃棒,其作用是 。
④反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会 (填“偏大”、“偏小”或“无影响”)。
根据题意填写下列空格:
(1)某微粒的结构示意图为 ![]() ,若X等于11,则该微粒表示_____???___(填“阳”或“阴”)离子。在N、N2、2N2三种符号中,只表示微观意义,而不表示宏观意义的是
,若X等于11,则该微粒表示_____???___(填“阳”或“阴”)离子。在N、N2、2N2三种符号中,只表示微观意义,而不表示宏观意义的是
(2)构成物质的基本微粒有分子、原子、离子。氯化钠是由 构成的;水是由 构成的;金(Au)是由 构成的。
(3)有下列物质:CO2 、CO 、H2 、CH4 ,其中通入紫色石蕊溶液,溶液变红的是___________, 最理想的燃料是_____???_____,属于有机物的是_____???_____。
(4)加钙牛奶中的“钙”是指 (填“元素”或“原子”),身体中一旦缺钙,可能患有的疾病是 (填“骨质疏松”或“贫血”)。
(5)通过晾晒海水或煮盐井水、盐湖水等方法,均可得到含有较多杂质的粗盐,这种方法属于__________变化(填“物理”或“化学”)。粗盐经过__________、过滤、__________
可得到初步提纯,再通过化学方法获得精盐。
(6)某同学用提取的精盐配制100g质量分数为11.7%的氯化钠溶液,请你参与完成:
①计算:氯化钠的质量为 g,水为 g。
②称量:用托盘天平称量,氯化钠应放在 (填“左盘”或“右盘”)。
③溶解:用量筒来量取所需的水(水的密度为1g/cm3),量筒的规格是 (从下列中选用:10mL、25 mL、50 mL、100 mL)。量取液体时,量筒必须放平,视线与液体的_________ 保持水平。溶解氯化钠要用到玻璃棒,其作用是 。
④反思:若称取的氯化钠中含有水分,则所配制的溶液溶质质量分数会 (填“偏大”、“偏小”或“无影响”)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com