
题目列表(包括答案和解析)
电解是最强有力的氧化还原手段,在化工生产中有着重要的应用。请回答下列问题:
(1)以铜为阳极,以石墨为阴极,用NaCl溶液作电解液进行电解,得到半导体材料Cu2O和一种清洁能源,则阳极反应式为___________________________,阴极反应式为________。
(2)某同学设计如图所示的装置探究金属的腐蚀情况。下列判断合理的是____________(填序号)。
a.②区铜片上有气泡产生
b.③区铁片的电极反应式为2Cl--2e-=Cl2↑
c.最先观察到变成红色的区域是②区
d.②区和④区中铜片的质量均不发生变化
(3)最新研究发现,用隔膜电解法处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛-Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式),电极反应式为____________________。电解过程中,阴极区Na2SO4的物质的量________(填“增大”、“减小”或“不变”)。
②在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3 000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。

 Ⅰ、电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.
Ⅰ、电解原理在化学工业中有广泛应用.图表示一个电解池,装有电解液c;A、B是两块电极板,通过导线与直流电源相连.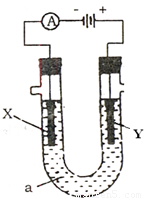
(14分)废旧电池乱扔不仅污染环境,更是一种资源的浪费。普通锌锰干电池是圆筒形的,外筒由锌制成,筒中央为碳棒,筒内黑色糊状物主要成分是淀粉、氯化铵、氯化锌和二氧化锰等。某研究性学习小组设计如下流程,变废为宝:

(1) “溶解”步骤中,为提高溶解速度,可采取的措施有加热、 等;
“操作Ⅰ”的名称是 ;
(2)检验“滤液b”中含有NH4+的方法是 。
(3) 某同学将黑色滤渣与足量的浓盐酸充分反应后的液体进行过滤,得到的滤渣还是黑色,该黑色物质在热的浓硫酸中能完全消失,则该黑色物质与浓硫酸反应的化学方程式为 。
(4) 二氧化锰还可大量用于炼钢、有机合成工业等。在制备高纯二氧化锰过程中,用FeSO4、稀H2SO4对软锰矿(主要成分为MnO2)进行酸浸富集锰元素生成Mn2+,写出酸浸时发生反应的离子方程式_________________________。
(5) 已知:SOCl2极易与水发生下列反应:SOCl2+H2O=SO2+2HCl。有人用SOCl2代替“操作Ⅱ”中的HCl气体,使其与ZnCl2·xH2O混合加热制取无水氯化锌,请你对使用SOCl2试剂作个评价 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com