
题目列表(包括答案和解析)
|
在101 kPa和25℃时,有反应的热化学方程式:H2(g)+1/2O2(g)=H2O(g); △H=-241.8 kJ/mol,H2(g)+1/2O2(g)=H2O(1);△H=-285.8 kJ/mol.下列说法中错误的是 | |
| [ ] | |
A. |
H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 |
B. |
H2的燃烧热为285.8 kJ |
C. |
O2前面的1/2表示参加反应的O2的物质的量 |
D. |
1 mol 流态水变成水蒸气时吸收44 kJ的热量 |
|
在101 kPa和25℃时,有反应的热化学方程式:H2(g)+1/2O2(g)=H2O(g);ΔH=-241.8 kJ/mol,H2(g)+1/2O2(g)=H2O(1);ΔH=-285.8 kJ/mol.下列说法中错误的是: | |
| [ ] | |
A. |
H2燃烧生成1 mol H2O(g)时,放出241.8 kJ的热量 |
B. |
H2的燃烧热为285.8 kJ |
C. |
O2前面的1/2表示参加反应的O2的物质的量 |
D. |
1 mol液态水变成水蒸气时吸收44 kJ的热量 |
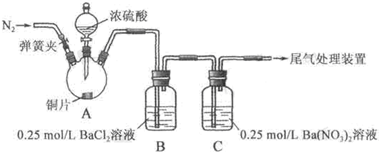
| 操作 | 现象 |
| 关闭弹簧夹,滴加一定量浓硫酸,加热 | A中有白雾生成,铜片表面产生气泡 B中有气泡冒出,产生大量白色沉淀 C中产生白色沉淀,液面上方略显浅棕色并逐渐消失 |
| 打开弹簧夹,通入N2,停止加热,一段时间后关闭 | --- |
| 从B、C中分别取少量白色沉淀,加稀盐酸 | 均未发现白色沉淀溶解 |
| ||
| ||
| 甲 | 大量白色沉淀 |
| 乙 | 少量白色沉淀 |
在101kPa和25℃时,热化学方程式:H2(g) + 1/2O2(g) =H2O(g);△H=-241.8kJ/mol,H2(g) + 1/2O2(g) =H2O(1);△H=-285.8kJ/mol。下列说法中错误的是: ( )
A.H2燃烧生成1molH2O(g)时,放出241.8kJ的热量
B.H2的燃烧热为285.8kJ
C.O2 前面的1/2表示参加反应的O2的物质的量
D.1mol液态水变成水蒸气时吸收44kJ的热量
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com