
题目列表(包括答案和解析)
 (2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.
(2012?东城区一模)臭氧是一种强氧化剂,常用于消毒、灭菌等.pH t/min T/℃ |
3.0 |
4.0 |
5.0 |
6.0 |
| 20 | 301 | 231 | 169 | 58 |
| 30 | 158 | 108 | 48 | 15 |
| 50 | 31 | 26 | 15 | 7 |

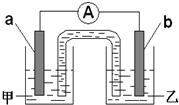 一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
一个完整的氧化还原反应方程式可以拆写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”.如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu→Cu2++2e-,还原反应式:2Fe3++2e-→2Fe2+.并由此实现了化学能与电能的相互转化.据此,回答下列问题:
| ||
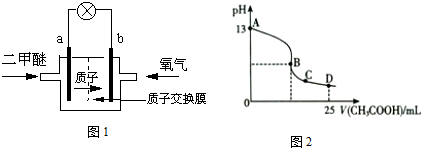 (1)二甲醚燃料电池的正极反应式为
(1)二甲醚燃料电池的正极反应式为
| ||
| ||
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com