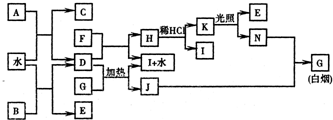
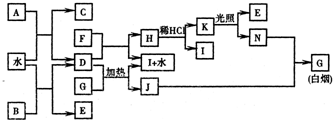
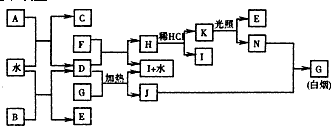
下图为某些常见物质之间的转化关系.已知:A、B、I中含有相同的阳离子且都是XY
2型化合物,且I是实验室常用的干燥剂;C为直线型分子;E、F为非金属气体单质.
请按要求填空:

(1)①B的电子式是
,②K的结构式是
H-O-Cl
H-O-Cl
;
(2)D与G反应的化学方程式是
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
2NH
4Cl+Ca(OH)
2CaCl
2+2NH
3↑+2H
2O
;
(3)已知C的燃烧热是1300kJ/mol,表示C的燃烧热的热化学方程式是
C
2H
2(g)+
O
2(g)=2CO
2(g)+H
2O(l)△H=-1300kJ/mol
C
2H
2(g)+
O
2(g)=2CO
2(g)+H
2O(l)△H=-1300kJ/mol
;
(4)将G溶于水配成溶液,简述检验该溶液G中所含阳离子的操作方法:
取少量的G溶液于试管中,加入适量的氢氧化钠溶液,加热试管,将湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则含有NH4+,(其他合理答案均给分)
取少量的G溶液于试管中,加入适量的氢氧化钠溶液,加热试管,将湿润的红色石蕊试纸放在试管口,若试纸变成蓝色,则含有NH4+,(其他合理答案均给分)
;
(5)常温下0.1mol/L的J溶液中c(H
+)/c(OH
-)=1×10
-8,下列叙述错误的是
BCE
BCE
;
A.该溶液的pH=11;
B.该溶液中的溶质电离出的阳离子浓度0.1mol/L
C.该溶液中水电离出的c(H
+)与c(OH
-)乘积为1×10
-22D.pH=3的盐酸溶液V
1 L与该0.1mol/L的J溶液V
2 L混合,若混合溶液pH=7,则:V
1>V
2E.将以上溶液加水稀释100倍后,pH值为9;
(6)单质F在工业上有重要的用途是
制漂白粉,制盐酸(制漂白液等)
制漂白粉,制盐酸(制漂白液等)
.(至少两种)