
题目列表(包括答案和解析)
在实验室进行“酸的性质”探究活动中,同学们使用过的物质有:
①铁屑
②铜片
③氧化铁
④氢氧化钠溶液
⑤碳酸钠溶液
⑥稀盐酸.
(1)实验结束,他们将废液倒入指定的废液缸中,小军同学向废液中滴加了几滴石蕊试液发现试液变成红色,这说明废液显________性.
(2)以上提供的6种试剂在废液中不可能存在的是________,你选择该物质的理由是(请任选一种用化学方程式回答)________.
(3)废液中可能存在的溶质化学式________.
(4)上述实验室产生的废液直接排放会引起污染,针对废液成分需加一种试剂将废液的pH调至中性,要求物美价廉,实用方便,你选择的物质是________应用的化学反应是________(一例即可).
(5)上述实验使用的①-⑥物质中,实验结束后需要回收的试剂是铜片.
| ||
| ||
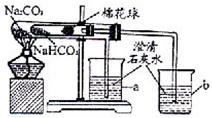 27、某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究.
27、某化学兴趣小组的同学在学习了纯碱(Na2CO3)的性质后,联想到家中蒸制馒头时常用的物质小苏打(NaHCO3),于是采用市售的小苏打样品进行了如下实验探究.碳铵( NH4HCO3)是一种常用的化学肥料,易溶于水,受潮时在常温下即能分解,温度越高分解越快,分解产物为NH3、CO2、H2O。碳铵遇碱放出密度比空气密度小的氨气。
(1)碳铵属于化肥中的______肥,化学性质______(填“稳定”或“不稳定”);保存时应注意__________________________________________________________________(写2条)。
(2)某兴趣小组欲在实验室利用如下图所示的装置研究碳铵的性质,请你一起参加。

①选择装置______(填序号)进行碳铵固体受热分解的实验,该反应的化学方程式为__________________________________;应用该装置,还可在实验室进行的实验是____________________________(答一个即可)。
②在装置a中加入碳铵和稀盐酸,将产生的气体通入澄清石灰水中,可观察到的现象是__________________,产生该现象的化学方程式为______________________ ___________。
___________。
③取少量碳铵和熟石灰粉末放入装置b的大试管中,微热片刻立即移开酒精灯。将产生的氨气缓缓通入酚酞溶液,酚酞溶液变红。可知,氨气易溶于水,其水溶液(氨水)显____性(填“酸”“碱”或“中”),pH____7(填“<”“>”或“=”)。
甲同学认为可用装置c干燥氨气,你认为他能否达到目的?____(填“能”或“不能”)。若要收集氨气,应选择的装置是________(填序号)。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com