
题目列表(包括答案和解析)
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
2.1 2.1 |
250 250 |
X、Y、Z、W是元素周期表短周期中的四种常见元素,其相关信息如下表:
|
元素 |
相关信息 |
|
X |
X的原子核外3个能级上有电子,且每个亚层上的电子数相等 |
|
Y |
常温常压下,Y单质是淡黄色固体,常在火山口附近沉积 |
|
Z[来源:Z&xx&k.Com] |
Z和Y同周期,Z的非金属性大于Y |
|
W |
W的一种同位素的质量数为28,中子数为14 |
(1)Y位在元素周期表位置是________________,
Y和Z的最高价氧化物对应的水化物的酸性较强的是 (写化学式)。
(2)XY2是一种常用的溶剂,XY2的分子的结构式为 。在H―Y、H―Z两种共价键中,
键的极性较强的是 。
(3)W的氧化物属于 晶体,请写出它的一种用途:_____________ 。
(4)处理含XO、YO2烟道气污染的一种方法,是将其在催化剂作用下转化为单质Y。
已知:
XO(g)+ O2(g)→XO2(g)+283.0
kJ·mol
O2(g)→XO2(g)+283.0
kJ·mol
Y(g)+ O2(g)→YO2(g)+296.0 kJ·mol
此反应的热化学方程式是 。
关于元素性质或特点的说法正确的是
A.最外层电子数≥4的元素均为非金属元素,
B.最外层电子数=2的元素均为第ⅡA族元素,
C.第m主族的非金属元素X的气态氢化物化学式为HmX,
D.在元素周期表中金属和非金属元素分界处可以找到半导体材料。[来源:Z+xx+k.Com]
(10分) 按要求填空
(1)配平下列化学方程式:并用单线桥标出电子转移的方向和数目。[来源:Z#xx#k.Com]
______Fe3O4 + ______CO = _____Fe +_______CO2
(2)检验SO42-所需要用的试剂__________________和__________________。
(3)三硅酸镁(Mg2Si3O8·11H2O)用氧化物表示_______________________。
(4)0.3 mol NH3 分子中所含质子数与________个H2O分子中所含质子数相等。
短周期元素形成的物质A、B、C、D、E,它们的转化关系如下图所示,物质A与物质B之间的反应不在溶液中进行(E可能与A、B两种物质中的某种相同)。
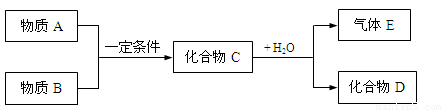
请回答下列问题:
(1)若C是离子化合物,D是一种强碱,写出C的电子式:____________________
(2)若E是有臭鸡蛋气味,D是既能溶于强酸,又能溶于强碱的化合物。
①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因:[来源:Z。xx。k.Com]
_________________________________________________________________________
②用等式表示E与NaOH溶液反应后生成正盐的溶液中所有离子浓度之间的关系:
_________________________________________________________________________
(3)若C是一种气体,D是一种强酸,且E与A相同,则C与水反应的化学方程式为(请标出电子转移方向和数目):
_________________________________________________________________________
(4)若A是一种单质,该元素的原子最外层电子数等于最内层,气体E能使湿润的红色石蕊试纸变蓝,那么化合物D是_____________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com