
题目列表(包括答案和解析)
(1)下图是一种用于显示事物异同点的信息处理方法。例如A图中的两个圆分别代表铝和铁的有关信息,两圆重叠的区域表示铝和铁的共同点(相似点),重叠区域以外的部分表示它们独有的特征(不同点)。请你在下面横线上用化学方程式来表示与图中①②区域对应的化学性质上的不同之处(每处只要求写一个)。
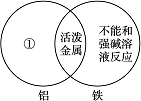 A
A
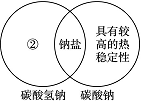 B
B
①________________________________________________________________________;
②________________________________________________________________________;
(2)为了测定铁铝合金中金属的质量分数,某校研究性学习小组设计了如下实验操作过程:称取该合金1.0g,放入烧杯中加足量盐酸,盖上表面皿,使其充分反应;反应停止,经冷却向其中加入过量NaOH溶液,充分静置后过滤,对滤出的沉淀经洗涤在空气中加热灼烧至恒重,得到固体物质1.2g。下列有关叙述不正确的是________。
A.铁的质量为0.84g
B.Al的质量分数为16%
C.加入过量NaOH溶液的目的是为了Fe2+完全沉淀
D.加入NaOH溶液后充分静置是为了保证Fe(OH)2被空气中的氧气充分氧化为Fe(OH)3
(3)Al(OH)3和NaHCO3都是治疗胃酸过多的药物,用离子方程式表示其原理,________________,______________。根据上述反应,如果是胃酸过多且有胃溃疡的患者,应该选用上述哪一种药物治疗为好________,理由是________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com