
题目列表(包括答案和解析)
A【物质结构与性质】纳米技术制成的金属燃料、非金属固体燃料、氢气等已应用到社会生活和高科技领域。
 ⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
⑴A和B的单质单位质量的燃烧热大,可用作燃料。已知A和B为短周期元素,其原子的第一至第四电离能如下表所示:
| 电离能(kJ/mol) | I1 | I2 | I3 | I4 |
| A | 932 | 1821 | 15390 | 21771 |
| B | 738 | 1451 | 7733 | 10540 |
①某同学根据上述信息,推断B的核外电子排布如右图所示,
该同学所画的电子排布图违背了 。
②根据价层电子对互斥理论,预测A和氯元素形成的简单分子空间构型为 。
 ⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
⑵氢气作为一种清洁能源,必须解决它的储存问题,C60可用作储氢材料。
①已知金刚石中的C-C的键长为154.45pm,C60中C-C键长为145~140pm,有同学据此认为C60的熔点高于金刚石,你认为是否正确并阐述理由 。
②科学家把C60和K掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体。该物质的K原子和C60分子的个数比为 。
③继C60后,科学家又合成了Si60、N60,C、Si、N原子电负性由大到小的顺序是 。Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为 。
B【实验化学】某化学研究性学习小组为测定果汁中Vc含量,设计并进行了以下实验。
Ⅰ 实验原理
 将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
将特定频率的紫外光通过装有溶液的比色皿,一部分被吸收,通过对比入射光强度和透射光强度之间的关系可得到溶液的吸光度(用A表示,可由仪器自动获得)。吸光度A的大小与溶液中特定成分的浓度有关,杂质不产生干扰。溶液的pH对吸光度大小有一定影响。
Ⅱ 实验过程
⑴配制系列标准溶液。分别准确称量质量为1.0mg、1.5mg、2.0mg、2.5mg的标准Vc试剂,放在烧杯中溶解,加入适量的硫酸,再将溶液完全转移到100mL容量瓶中定容。
上述步骤中所用到的玻璃仪器除烧杯、容量瓶外还有 。
⑵较正分光光度计并按顺序测定标准溶液的吸光度。为了减小实验的误差,实验中使用同一个比色皿进行实验,测定下一溶液时应对比色皿进行的操作是 。测定标准溶液按浓度 (填“由大到小”或“由小到大”)的顺序进行。
⑶准确移取10.00mL待测果汁样品到100mL容量瓶中,加入适量的硫酸,再加水定容制得待测液,测定待测液的吸光度。
Ⅲ 数据记录与处理
 ⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
⑷实验中记录到的标准溶液的吸光度与浓度的关系如下表所示,根据所给数据作出标准溶液的吸光度随浓度变化的曲线。
| 标准试剂编号 | ① | ② | ③ | ④ | 待测液 |
| 浓度mg/L | 10 | 15 | 20 | 25 | — |
| pH | 6 | 6 | 6 | 6 | 6 |
| 吸光度A | 1.205 | 1.805 | 2.405 | 3.005 | 2.165 |
⑸原果汁样品中Vc的浓度为 mg/L
⑹实验结果与数据讨论
除使用同一个比色皿外,请再提出两个能使实验测定结果更加准确的条件控制方法 。
非金属知识规律总结
【高考导航】
一、非金属元素在周期表中的位置和结构特点
1、除H外,非金属元素均在“阶梯线”的右上方。共有16种非金属元素,其中包括稀有气体元素6种。
2、非金属元素(包括稀有元素)均在主族(零族)。非金属元素一般都有变价。
3、最外层电子数一般≥4(H、B除外)。
4、原子半径比同周期金属半径小(稀有元素除外)。
二、非金属性强弱的判断依据
元素非金属性的本质是元素的原子吸引电子的能力。试题常通过以下几个方面来比较元素的非金属性:
1、单质跟H2化合难易程度(反应条件,剧烈程度,反应热的大小,生成气态氢化物的稳定性)。
2、最高价氧化物对应水化物的酸性。
3、化合物中元素化合价的正负,如BrCl中,Cl为-1价,Br为+1价,说明非金属性Cl>Br。
4、通过氧化还原反应确定非金属单质的氧化能力,进而比较非金属性。
需要指出的是,非金属单质的活动性与非金属元素的活动性,有密切的联系,但不是一回事。例如氮元素的非金属性相当强,可是它的单质N2化学性质却不很活泼。单质的化学性质不仅取决于原子结构,而且取决于分子结构和晶体结构。
三、非金属元素的性质及递变规律
1、单质:
(1)结构:除稀有气体外,非金属原子间以共价键结合。非金属单质的成键有明显的规律性。若它处在第N族,每个原子可提供8-N个价电子去和8-N个同种原子形成8-N个共价单键,可简称8-N规则;(H遵循2-N规则)。如ⅦA族单质:x-x;H的共价数为1,H-H,第ⅥA族的S、Se、Te共价单键数为8-6=2,第ⅤA族的P、As共价单键数8-5=3。但第二周期的非金属单质中N2、O2形成多键。
(2)熔沸点与聚集态。它们可以分为三类:
①小分子物质。如:H2、O2、N2、Cl2等,通常为气体,固体为分子晶体。
②多原子分子物质。如P4、S8、As4等,通常为液态或固态。均为分子晶体,但熔、沸点因范德华力较大而比①高,Br2、I2也属此类,一般易挥发或升华。
③原子晶体类单质。如金刚石、晶体硅和硼等,是非金属单质中高熔点“三角区”,通常为难挥发的固体。
(3)导电性:非金属一般属于非导体,金属是良导体,而锗、硅、砷、硒等属于半导体。但半导体与导体不同之处是导电率随温度升高而增大。
(4)化学活性及反应:

③非金属一般为成酸元素,难以与稀酸反应。 固体非金属能被氧化性酸氧化。

2、氢化物:
(1)气态氢化物性质比较
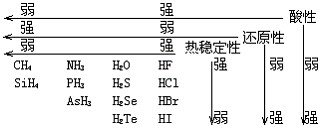
(2)由于氢键的存在,使得第ⅤA、ⅥA、ⅦA氢化物的熔沸点出现了反常。第ⅤA中:SbH3>NH3>AsH3>PH3;第ⅥA中: H2O>H2Te>H2Se>H2S;第ⅦA中HF>HI>HBr>HCl。
(3)气态氢化物水溶液的酸碱性及与水作用的情况。①HCl、HBr、HI溶于水成酸且都是强酸。②HF、H2S、H2Se、H2Te溶于水成酸且都是弱酸。③NH3溶于水成碱,氨水是弱碱。④PH3、AsH3、CH4与水不反应。⑤SiH4、B2H6与水作用时分解并放出H2。
3、非金属氧化物的通性:
(1)许多非金属低价氧化物有毒,如SO2、NO、NO2、CO等,注意不能随便排放于大气中。
(2)非金属氧化物(除SiO2外)大都是分子晶体,熔沸点相差不大。
(3)非金属氧化物大都为酸酐,相应的酸易溶于水,则氧化物易与水化合,反之水化反应难以进行。
(4)不成盐氧化物(如CO、NO)不溶于水,也不与碱反应。虽然NO2能与碱反应生成盐,但NO2不属于酸酐。
4、含氧酸
(1)同周期非金属元素最高价含氧酸从左到右酸性增强。
(2)氧化性:同种元素低价强于高价含氧酸.
如:HClO>HClO3>HClO4(稀)
H2SO3>H2SO4(稀)
HNO2>HNO3(稀)
(3)对于同种非金属形成的不同含氧酸,价态越高,酸性越强。其顺序如:HClO4>HClO3>HClO2>HClO,H2SO4>H2SO3。
(4)难挥发的H2SO4、H3PO4受热难分解;强氧化性的HNO3、HNO2、HClO见光或受热易分解;非氧化性的H2CO3、H2SO3易分解。强酸可制弱酸,难挥发性酸制挥发性酸。
(5)常见含氧酸的一般性质:
①H2SO4:无色粘稠的油状液体,强酸,沸点高,不挥发,稳定。浓硫酸有吸水性、脱水性和强氧化性。
②H2SO3:仅存在于溶液中,中强酸,不稳定。
③HClO4:在水溶液中相当稳定,最强无机酸,有强氧化性。
④HClO:仅存在于溶液中,是一种弱酸,有强氧化性和漂白性,极不稳定,遇光分解。⑤HNO3:无色液体,强酸,沸点低,易挥发,不稳定,易分解,有强氧化性。
⑥H3PO4:无色晶体,中强酸,难挥发,有吸水性,稳定,属于非氧化性酸。
⑦H2CO3:仅存在于溶液中,弱酸,不稳定。
⑧H2SiO3:白色固体,不溶于水,弱酸,不挥发,加热时可分解。
⑨常见酸的酸性强弱。强酸:HCl、HNO3、H2SO4;中强酸:H2SO3>H3PO4(H3PO4中强偏弱);弱酸:HF>CH3COOH>H2CO3>H2S>HClO>H2SiO3。
四、11种无机化学气体的制取和性质(O2、H2、Cl2、CO、NO、SO2、NO2、CO2、H2S、HCl、NH3)。
(1)利用氧化还原反应原理制取的气体有:O2、H2、Cl2、NO、NO2等。
(2)利用复分解制取的气体有:SO2、CO2、H2S、HCl、NH3等。
(3)可用启普发生器制取的气体有:H2、CO2、H2S等。
(4)只能用排气法收集的是:Cl2、SO2、NO2、CO2、H2S、HCl、NH3等。只能用排水法收集的气体是:NO、CO。
(5)使红色石蕊变蓝的气体是NH3;使石灰水变浑浊的气体是SO2和CO2;使品红溶液褪色的气体是SO2和Cl2;使高锰酸钾溶液和溴水褪色的气体有H2S和SO2。
(6)臭鸡蛋气味的气体是H2S;刺激性气味的气体有:Cl2、SO2、NO2、HCl、NH3等;毒性气体有:Cl2、CO、NO、SO2、NO2、H2S等。
(7)能在空气中燃烧的气体:H2S、CO、H2等
| X的基态原子中电子分布在三个不同的能级中,且每个能级的电子总数相同 |
| Y元素的气态氢化物与其最高价氧化物对应的水化物能发生化学反应 |
| Z元素的族序数是周期数的三倍 |
| W原子的第一至第六电离能分别为:I1=578kJ?mol-1,I2=1817kJ?mol-1, I3=2745kJ?mol-1,I4=11575kJ?mol-1,I5=14830kJ?mol-1,I6=18376kJ?mol-1 |
| Q为前四周期中电负性最小的元素 |
| R位于周期表的第11列 |
 或
或
 或
或
 ”标志的是
”标志的是清洗和制绒是硅晶片制作的重要步骤之一,硅片化学清洗的主要目的是除去硅片表面杂质(如某些有机物,无机盐,金属、Si、SiO2粉尘等)。常用的化学清洗剂有高纯水、有机溶剂、双氧水、浓酸、强碱等。其中去除硅的氧化物,通常用一定浓度的HF溶液,室温条件下将硅片浸泡1至数分钟。制绒是在硅片表面形成金字塔形的绒面,增加硅对太阳光的吸收。单晶制绒通常用NaOH,Na2SiO3等混合溶液在75~90℃反应25~35 min,效果良好。
回答下列问题
(1)能否用玻璃试剂瓶来盛HF溶液,为什么?用化学方程式加以解释 ;
(2)写出晶片制绒反应的离子方程式 ,对单晶制绒1990年化学家Seidel提出了一种的电化学模型,他指出Si与NaOH溶液的反应,首先是Si与OH一反应,生成SiO44一,然后SiO44一迅速水解生成H4SiO4。基于此原理分析反应中氧化剂为 。
(3)本校化学兴趣小组同学,为验证Seidel的理论是否正确,完成以下实验:
|
|
实验事实 |
|
事实一 |
水蒸汽在600℃时可使粉末状硅缓慢氧化并放出氢气。 |
|
事实二 |
盛放于铂或石英器皿中的纯水长时间对粉末状还原硅无腐蚀作用。 |
|
事实三 |
普通玻璃器皿中的水仅因含有从玻璃中溶出的微量的碱便可使粉末状硅在其中缓慢溶解。 |
|
事实四 |
在野外环境里,用较高百分比的硅铁粉与干燥的Ca(OH)2和NaOH,点着后焖烧,可剧烈放出H2。 |
|
事实五 |
1g(0.036mo1)Si和20mL含有lgNaOH(0.025mol)的溶液,小心加热(稍微预热),收集到约1700mL H2,很接近理论值(1600mL)。 |
结论:从实验上说明碱性水溶液条件下,H2O可作 剂;NaOH作 剂,降低反应 。高温无水环境下,NaOH作 剂。
(4)在太阳能电池表面沉积深蓝色减反膜——氮化硅晶膜。常用硅烷(SiH4)与氨气(NH3)在等离子体中反应。硅烷是一种无色、有毒气体,常温下与空气和水剧烈反应。下列关于硅烷、氮化硅的叙述不正确的是 。
A.在使用硅烷时要注意隔离空气和水,SiH4能与水发生氧化还原反应生成H2;
B.硅烷与氨气反应的化学方程式为:3SiH4+4NH3=Si3N4+12H2↑,反应中NH3作氧化剂;
C.它们具有卓越的抗氧化、绝缘性能和隔绝性能,化学稳定性很好,不与任何酸、碱反应;
D.氮化硅晶体中只存在共价键,Si3N4是优良的新型无机非金属材料。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com