
题目列表(包括答案和解析)
(12分)氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,其流程如下图所示:
有关氢氧化物沉淀完全的pH见下表
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,而且要通入空气,理由是 。
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂Ⅰ”步骤中,经常使用酸性高锰酸钾溶液,并调节溶液的pH。将溶液调至pH=4的目的是 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],请写出碳化合成步骤的化学方程式 。
(5)在“洗涤”过程中,证明沉淀洗涤完全的标志是 。
(6)由于本工艺液固分离次数较多,明显的不足是 。
(12分)氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,其流程如下图所示:
有关氢氧化物沉淀完全的pH见下表
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,而且要通入空气,理由是 。
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂Ⅰ”步骤中,经常使用酸性高锰酸钾溶液,并调节溶液的pH。将溶液调至pH=4的目的是 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],请写出碳化合成步骤的化学方程式 。
(5)在“洗涤”过程中,证明沉淀洗涤完全的标志是 。
(6)由于本工艺液固分离次数较多,明显的不足是 。
(12分)氧化锌为白色粉末,无臭、无味,广泛应用于橡胶、涂料、陶瓷、化工、医药、玻璃和电子等行业,为了变废为宝,综合应用资源,经常从锌冶炼、锌制品加工企业回收的废渣(含有ZnO、FeO、Fe2O3、CuO、Al2O3等杂质)来制取氧化锌,其流程如下图所示:
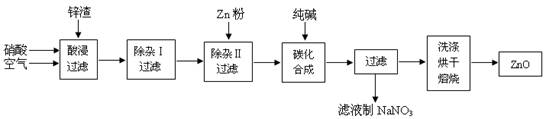
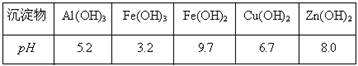
有关氢氧化物沉淀完全的pH见下表
回答下列问题
(1)在酸浸过程中,经常要保持酸过量,而且要通入空气,理由是 。
(2)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(3)在“除杂Ⅰ”步骤中,经常使用酸性高锰酸钾溶液,并调节溶液的pH。将溶液调至pH=4的目的是 。
(4)在“碳化合成”中,生成的产物之一为碱式碳酸锌[Zn2(OH)2CO3],请写出碳化合成步骤的化学方程式 。
(5)在“洗涤”过程中,证明沉淀洗涤完全的标志是 。
(6)由于本工艺液固分离次数较多,明显的不足是 。

碘酸钾是一种白色粉末,无臭无味,加碘食盐中常加入它,国家规定每千克食盐中应含40~50 mg碘酸钾酸性条件下碘酸钾是一种较强的氧化剂,与氢碘酸、二氧化硫等还原性物制质作用,被还原为单质碘,在碱性介质中,碘酸钾能被氯气、次氢酸盐等氧化为高碘酸钾.碘酸钾在常温下稳定,加热至560℃开始分解.工业生产碘酸钾的流程如下,在反应器中发生反应的化学方程式为:6I2+11KClO3+3H2O-6KH(IO3)2+5KCl+3Cl2

1、④的操作名称可能是________.
2、步骤②中,用稀硝酸酸化而不用氢碘酸(HI),其原因可能是________;
3、步骤③要保持溶液微沸1小时是为了排出________,排出该物质的原因为________;
4、X的化学式为________写出用试剂X调节pH的化学方程式________.
5、实验中涉及两次过滤,在实验室进行过滤实验中,用到的玻璃仪器有________;
6、已知:IO3-+I-+H+→I2+H2O(未配平),I2+2S2O32-→2I-+S4O62-.某学生测定食用精制盐的碘化钾的含量,其步骤为
a.准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液40.0 mL;
d.以淀粉为指示剂,逐滴加入1.00×10-3 mol·L-1碘水10.0 mL恰好反应完全.
Ⅰ.判断d中恰好反应完全的现象是________.
Ⅱ.配平方程式:________IO3-+________I-+________H+→________I2+________H2O
Ⅲ.根据以上实验,所测精制盐中碘酸钾含量是(以含w的代数式表示)________mg/kg.
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com