
题目列表(包括答案和解析)
 二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.
二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.| 50a |
| 13 |
| 50a |
| 13 |
(1)写出电解饱和氯化钠溶液时的电极反应式和总的离子反应方程式。?
阳极: ,阴极: ;?
总反应方程式: 。?
(2)离子交换膜电解槽一般采用金属钛作阳极,其原因是 ,阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是 。
(3)为使电解氯化钠的速率加快,下列措施可行的是 。
a.增大阴极碳钢网面积 b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离 d.提高电解时的电源电压?
(4)电解之前食盐水需要精制,目的是除去粗盐中的Ca2+、Mg2+、SO2-4等杂质离子,使用的试剂有:?a.Na2CO3?溶液; b.Ba(OH)2溶液; c.稀盐酸。其合理的加入顺序为 (填试剂序号)。
(5)如果在容积为10 L的离子交换膜电解槽中,1 min在阴极可产生11.2 L(标准状况)Cl2,这时溶液的pH是(设体积维持不变) 。?
(6)Cl2常用于自来水的消毒杀菌,现在有一种新型消毒剂ClO2,若它们在杀菌过程中的还原产物均为Cl-,消毒等量的自来水,所需用Cl2和ClO2的物质的量之比为 。?
二氧化氯泡腾片,有效成分(ClO2)是一种高效、安全的杀菌、消毒剂。
方法一:氯化钠电解法是一种可靠的工业生产ClO2气体的方法。该法工艺原理如图。其过程是将食盐水在特定条件下电解得到的氯酸钠(NaClO3)与盐酸反应生成ClO2。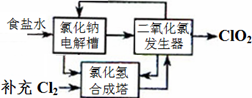
(1)工艺中可利用的单质有__________(填化学式),发生器中生成ClO2的化学方程式为_____________。
(2)此法的缺点主要是______________________________________。
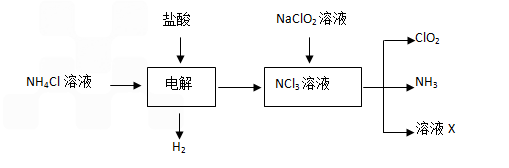
方法二:最近,科学家又研究出了一种新的制备方法,纤维素还原法制ClO2,其原理是:纤维素水解得到的最终产物X与NaClO3反应生成ClO2。
(3)配平方程式: □ (X) +□NaClO3+□H2SO4→□ClO2↑+□CO2↑+□H2O+□______
若反应中产生4.48L(折算成标准状况下)气体,电子转移________ 个。
(4)ClO2和Cl2均能将电镀废水中的CN—氧化为无毒的物质,自身被还原为Cl—。处理含CN—相同量的电镀废水,所需Cl2的物质的量是ClO2的_______倍。
方法三:实验室常用氯酸钠(NaClO3)和亚硫酸钠(Na2SO3)用硫酸酸化,加热制备二氧化氯,化学反应方程式为:2NaClO3+Na2SO3+H2SO4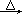 2ClO2↑+2Na2SO4+H2O
2ClO2↑+2Na2SO4+H2O
(5)反应中的Na2SO3溶液中存在如下平衡:H2O H++OH-和 ________________(用离子方程式表示).
H++OH-和 ________________(用离子方程式表示).
常温下,0.1mol/L该溶液中离子浓度由大到小排列__________________(用离子符号表示)
(6)常温下,已知NaHSO3溶液呈酸性,在Na2SO3溶液中滴加稀盐酸至中性时,溶质的主要成分有________________。(用化学式表示)


| 实验步骤 | 实验现象 | 实验结论 |
| ①______ | ______ | 溶液X中含有钠离子 |
| ②______ | ______ | 溶液X中含有氯离子 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com