
题目列表(包括答案和解析)
(10分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做了以下实验,如图Ⅰ―Ⅳ所示。
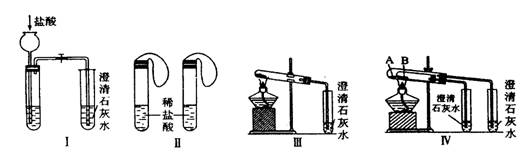
(1) 只根据图I、II所示实验,能够更好的达到实验目的是(填装置序号)__________;
(2)图III、IV所示实验均能鉴别这两种物质,其反应的化学方程式为_____ ;与实验III相比,实验IV的优点是(填选项序号)_______________;
A.IV比III复杂
B.IV比III安全
C.IV比III操作简便
D.IV可以做到用一套装置同时进行两个对比实验,而III不行
(3)若用实验IV验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是___;
(4)将碳酸氢钠溶液与澄清石灰水混合并充分反应。
①当石灰水过量时,其离子方程式为___________________ ;
②当碳酸氢钠与氢氧化钙物质的量之比为2 : 1时,所得溶液中溶质的化学式为_________,请设计实验检验所得溶液中溶质的阴离子 。
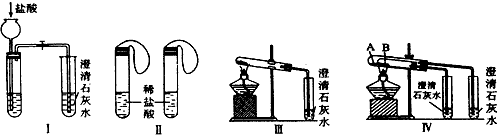
| |||||||||||||||||||||||||||||
本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选定其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A.诺贝尔物理学奖曾授予Henry Bragg和Lawrence Bragg,以表彰他们用X射线对晶体结构的分析所作的贡献。
(1)在硼酸[B(OH)3]分子中,B原子与3个羟基相连,其晶体具有与石墨相似的层状结构。则分子中B原子杂化轨道的类型为 ,同层分子间的主要作用为 。
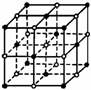 (2)K3[Fe(CN)6]晶体中含有的化学键类型为 ,
(2)K3[Fe(CN)6]晶体中含有的化学键类型为 ,
Fe3+与CN-之间能够形成化学键的原因是 。
(3)等物质的量的氧化物MO与SiC的电子总数相等,则M2+
离子的核外电子排布式为 。
MO是优良的耐高温材料,其晶体结构与NaCl晶体相
似,晶体中与每个M2+等距离且最近的几个O2-所围成
的空间几何构型为 。
MO的熔点比CaO的高,原因是 。
B.某化工废液中可能含有下列微粒:Al3+、Fe3+、NO2-、甘油分子。化学兴趣小组的同学设计了下列实验验证这些微粒的存在。
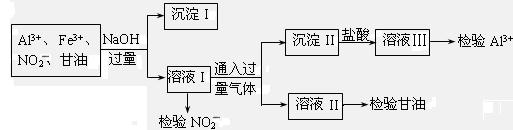
(1)分离出沉淀I的操作名称是 ,利用沉淀I可检验出 离子。
(2)通入的过量气体是 。(写化学式)
(3)用酸性KI溶液检验NO2-离子的离子方程式为 。
(4)写出检验甘油所发生反应的化学方程式: 。
(5)若向溶液III中先加足量NH4F后加氨水来检验Al3+离子,则能否达到目的?
答: (填“能”或“不能”);原因是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com