
题目列表(包括答案和解析)
| 通电 |
| 一定条件 |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |
| c4(NH3)?c3(O2) |
| c2(N2)?c6(H2O) |

A、B、X、Y、Z、W六种短周期主族元素,A是地壳中含量最多的金属元素,短周期主族元素中B的原子半径最大,X、Y、Z、W元素在周期表中的相对位置如图所示,其中Z元素原子最外层电子数是电子层数的2倍。请回答下列问题:
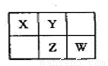
(1)W的最高价氧化物化学式是 ;Z的原子结构示意图为 。
(2)A、B各自最高价氧化物对应的水化物反应的化学方程式为 。
(3) AW3可用于净水,其原理是 。(请用离子方程式表示)
(4)工业合成X的简单气态氢化物是放热反应。下列措施中既能提高反应速率,又能提高原料转化率的是___ _。
a.升高温度
b.加入催化剂
c.将X的简单气态氢化物及时移离
d.增大反应体系的压强
(5)标准状况下,2.24L X的简单气态氢化物被100 mL l mol L-1X的最高价氧化物对应的水化物溶液吸收后,所得溶液中离子浓度从大到小的顺序是(用离子符号表示) 。
(6)WY2在杀菌消毒的同时,可将剧毒氰化物氧化成两种无毒气体而除去,写出用WY2(沸点9.9℃)氧化除去CN-的离子方程式___ _。
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列问题:

(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。

①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
(每空3分,共12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g) CH3OH(g)根据题意完成下列各题:
CH3OH(g)根据题意完成下列各题:
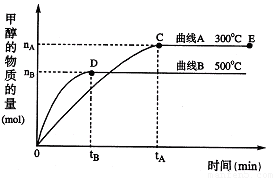
(1)在500℃,从反应开始到刚好达到平衡,氢气的平均反应速率ν(H2)= (用图中相应字母表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的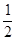 ,下列有关该体系的说法正确的是
(填序号)
,下列有关该体系的说法正确的是
(填序号)
a 氢气的浓度减少 b 正反应速率加快,逆反应速率变慢,平衡正向移动
c 甲醇的物质的量增加 d 重新平衡时c(CO)/c(CH3OH)增大
(3)从反应的方向判断,正向进行的反应 (填序号:A. 高温时 B.低温时 C.任何温度都能 D.任何温度都不能)自发进行。
(4)在不改变反应物用量的情况下,提高CO的转化率采取的措施是
(答两点即可)
(每空3分,共12分)一定条件下,在体积为3 L的密闭容器中,一氧化碳与氢气反应生成甲醇:CO(g)+2H2(g)CH3OH(g)根据题意完成下列各题:
(1)在500℃,从反应开始到刚好达到平衡,氢气的平均反应速率ν(H2)= (用图中相应字母表示)
(2)在其他条件不变的情况下,将处于E点的体系的体积压缩到原来的![]() ,下列有关该体系的说法正确的是 (填序号)
,下列有关该体系的说法正确的是 (填序号)
a 氢气的浓度减少 b 正反应速率加快,逆反应速率变慢,平衡正向移动
c 甲醇的物质的量增加 d 重新平衡时c(CO)/c(CH3OH)增大
(3)从反应的方向判断,正向进行的反应 (填序号:A. 高温时 B.低温时 C.任何温度都能 D.任何温度都不能)自发进行。
(4)在不改变反应物用量的情况下,提高CO的转化率采取的措施是
(答两点即可)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com