
题目列表(包括答案和解析)
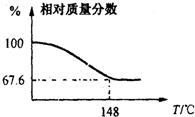 (2012?信阳一模)Na2CO3和H2O2结合成棒状晶体Na2CO3?xH2O2(过氧化氢相当于水合.Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质.注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源.现称取一定质量的Na2CO3?xH2O2晶体加热.实验结果以温度和残留固体的相对质量分数示如图.
(2012?信阳一模)Na2CO3和H2O2结合成棒状晶体Na2CO3?xH2O2(过氧化氢相当于水合.Na2CO3?xH2O2同时具有Na2CO3和H2O2的性质.注意:使用高浓度H2O2时一定要小心,防止爆炸生成水和氧气),可消毒、漂白或作O2源.现称取一定质量的Na2CO3?xH2O2晶体加热.实验结果以温度和残留固体的相对质量分数示如图.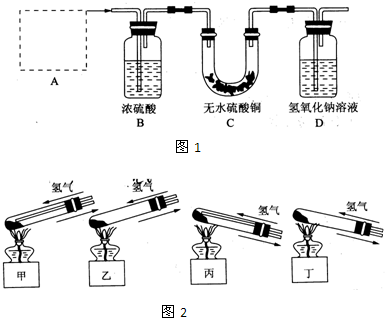
| 温度(℃) | 10 | 20 | 30 | 加热煮沸后冷却到50℃ |
| pH | 8.3 | 8.4 | 8.5 | 8.8 |
| 一定条件 |
| 一定条件 |
| ||
| △ |


| △ |
| △ |


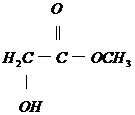
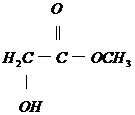


请从给出的3道化学题中任选一题做答
1.[化学——选修化学与技术]
请回答氯碱工业中的如下问题:
(1)氯气、烧碱是电解食盐水时按照固定的比率k(质量比)生成的产品。理论上k__________(要求计算表达式和结果);
(2)原料粗盐中常含有泥沙和Ca2+、Mg2+、Fe3+、 等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
等杂质,必须精制后才能供电解使用。精制时,粗盐溶于水过滤后,还要加入的试剂分别为①Na2CO3、②HCl(盐酸)、③BaCl2,这3种试剂添加的合理顺序是_________(填序号);
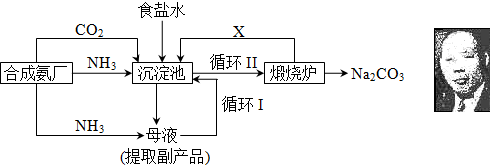
(3)氯碱工业是高耗能产业,一种将电解池与燃料电池相组合的新工艺可以节(电)能30%以上。在这种工艺设计中,相关物料的传输与转化关系如下图所示,其中的电极未标出,所用的离子膜都只允许阳离子通过。

①图中X、Y分别是_________、_________(填化学式),分析比较图示中氢氧化钠质量分数a%与b%的大小_________;
②分别写出燃料电池B中正极、负极上发生的电极反应
正极:_________;负极:_________;
③这样设计的主要节(电)能之处在于(写出2处)
___________________________、___________________________。
2.[化学——选修物质结构与性质]
已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为_________,该元素的符号为_________;
(2)Y元素原子的价层电子的轨道表示式为_________,该元素的名称是_________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为________________________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是____________________________________;
(5)比较X的氢化物与同族第二、三周期元素所形成的氢化物稳定性、沸点高低并说明理由____________________________________。
3.[化学——选修有机化学基础]
A~J均为有机化合物,它们之间的转化如下图所示:

实验表明:
①D既能发生银镜反应,又能与金属钠反应放出氢气;
②核磁共振氢谱表明F分子中有三种氢,且其峰面积之比为1∶1∶1;
③G能使溴的四氯化碳溶液褪色;
④1 mol J与足量金属钠反应可放出22.4 L氢气(标准状况)。
请根据以上信息回答下列问题:
(1)A的结构简式为_________(不考虑立体异构),由A生成B的反应类型是_________反应;
(2)D的结构简式为___________________________;
(3)由E生成F的化学方程式为____________,E中的官能团有____________(填名称),与E具有相同官能团的E的同分异构体还有____________(写出结构简式,不考虑立体异构);
(4)G的结构简式为____________________________________;
(5)由I生成J的化学方程式为________________________。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com