
题目列表(包括答案和解析)
溶质的物质的量:称量易吸水潮解的固体
(如NaOH)时,正确的方法是________.将溶解好的溶液转移至容量瓶后,要对玻璃棒和烧杯进行洗涤,然后将洗涤液一同转入容量瓶,以保证所有的溶质全部进入容量瓶(注意:稀释浓溶液的量筒不能洗涤).容量瓶在使用前不能用待配溶液润洗.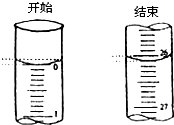 某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:
某学生欲用已知物质的量浓度的盐酸来滴定测定未知物质的量浓度的氢氧化钠溶液时,选择酚酞作指示剂.请填写下列空白:| 滴定次数 | 待测氢氧化钠 溶液的体积/mL |
0.1000mol/L盐酸的体积(mL) | ||
| 滴定前刻度 | 滴定后刻度 | 溶液体/mL | ||
| 第一次 | 25.00 | 0.00 | 26.11 | 26.11 |
| 第二次 | 25.00 | 1.56 | 30.30 | 28.74 |
| 第三次 | 25.00 | 0.22 | 26.31 | 26.09 |
(14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示:
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中 (填“实线”或“虚线”)。
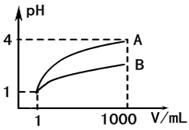
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是 和 。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于 (填仪器名称)中,用蒸馏水稀释10倍。
B.用 (填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入 (填指示剂名称)1~2滴。
C.用0.05 mol·L−1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视 ;终点现象是 。
②误差分析:下列操作中能使测定结果偏高的是 。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是 。
(14分)
室温下,已知HCl溶液与NaOH溶液的酸碱滴定曲线如下图所示: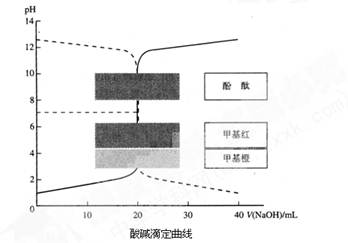
(1)向一定量的NaOH溶液中滴加HCl溶液的曲线为图中 (填“实线”或“虚线”)。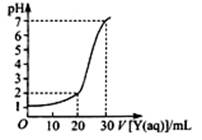
(2)上图为对10mL一定物质的量浓度的NaHSO4溶液X用一定物质的量浓度的氢氧化钠溶液Y滴定的图象,依据图象推出X和Y的物质的量浓度分别是 和 。
(3)某研究性学习小组的研究课题:食醋中总酸量(g/100mL)的测定。他们进行以下滴定操作:
A.取某品牌白醋25.00mL置于 (填仪器名称)中,用蒸馏水稀释10倍。
B.用 (填仪器名称)量取稀释后的白醋溶液20.00mL,置于250mL锥形瓶中,滴入 (填指示剂名称)1~2滴。
C.用0.05 mol·L?1NaOH标准溶液滴定,至终点。记下初始与终点读数。
(注意:滴定重复进行3次。)
根据以上操作,请你继续回答下列问题。
①操作(C)中,滴定时,两眼注视 ;终点现象是 。
②误差分析:下列操作中能使测定结果偏高的是 。
a.稀释白醋的蒸馏水预先未经过煮沸处理
b.盛NaOH溶液的碱式滴定管未用标准液润洗
c.滴定前读数正确,滴定终点时俯视读数
d.接近终点时,用少量蒸溜水洗涤锥形瓶
③如果该小组检测结果与该品牌商标上所注不一致,可能的原因之一是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com