
题目列表(包括答案和解析)
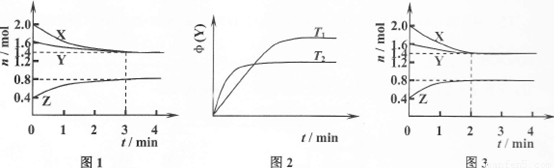
T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为Tl和T2时,Y的体积分数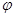 (Y)与时间的关系如图2所示。则下列结论错误的是
(Y)与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g)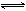 2Z(g)
2Z(g)
B.反应进行的前4min内,用X表示的反应速率v(X)=0.15mo1•(L•min)—1
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是( )
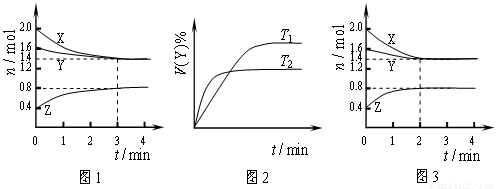
A、容器中发生的反应可表示为:3X(g)+Y(g)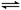 2Z(g)
2Z(g)
B、保持其他条件不变,升高温度,平衡逆向移动
C、反应进行的前3min内,用X表示的反应速率 v(X)=0.1mol•L-1•min-1
D、若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
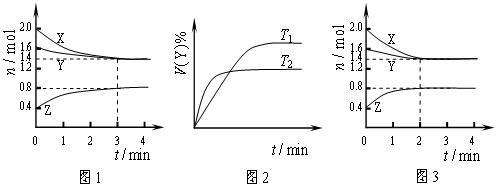
T℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为Tl和T2时,Y的体积分数 (Y)与时间的关系如图2所示。则下列结论错误的是
(Y)与时间的关系如图2所示。则下列结论错误的是
A.容器中发生的反应可表示为:3X(g)+Y(g) 2Z(g) 2Z(g) |
| B.反应进行的前4min内,用X表示的反应速率v(X)=0.15mo1?(L?min)—1 |
| C.保持其他条件不变,升高温度,反应的化学平衡常数K减小 |
| D.若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂 |
 2Z(g)
2Z(g) T ℃时在2L刚性密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是( )
A、容器中发生的反应可表示为:3X(g)+Y(g)![]() 2Z(g)
2Z(g)
B、保持其他条件不变,升高温度,平衡逆向移动
C、反应进行的前3min内,用X表示的反应速率 v(X)=0.1mol??L-1??min-1
D、若改变反应条件,使反应进程如图3所示,则改变的条件是使用催化剂
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com