
题目列表(包括答案和解析)
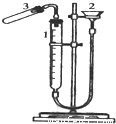
(17分)合成氨工业上常用下列方法制备H2:
方法:
方法:

试计算25℃时由方法②制备l000g H2所放出的能量为_________ kJ。
(2)在一定的条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器,发生反应: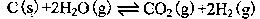 其相关数据如下表所示:
其相关数据如下表所示: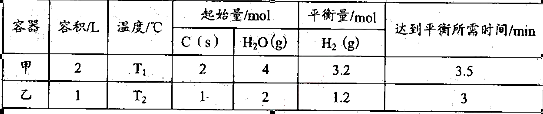
①T1_________T2(填“>”、“=”或“<”);
T1℃时,该反应的平衡常数K="_________" 。
②乙容器中,当反应进行到1.5min时,H2O(g)的物质的量浓度范围是_________。
③一定条件下,在密闭恒容的容器中,能表示上述反应达到化学平衡状态的是_________。
A.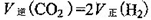
B.混合气体的密度保持不变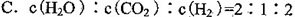
D.混合气体的平均相对分子质量保持不变
④某同学为了研究反应条件对化学平衡的影响,测得逆反应速率与时间的关系如图所示: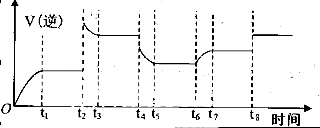
可见在t1、t3、t5、t7时反应都达了到平衡状态,如果t2、t4、t6、t8时都只改变了一个反应条件,则从t1到t8哪个时间段H2O (g)的平衡转化率最低_________,t4时刻改变的条件是__________。
⑤在25 ℃时,c mol/L,的醋酸与0.02mol/L NaOH溶液等体积混合后溶液刚好呈中性,
用含c的代数式表示CH3COOH的电离常数Ka=_________。
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为:
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化 B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化 D. 容器中总的物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)某高温下,若该5 L密闭容器中加入的是2molFe(s)与1.00mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.50mol 。
(1) t1~t2这段时间内的化学反应速率v(H2)= 。
(2)计算该可逆反应t2达到平衡时的K值。(要求写出计算过程)
(3)该反应的逆反应速率随时间变化的关系如右图。t1时改变了某种条件,改变的条件可能是 、 。(填写2项)
一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为:
(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
| A.容器中气体的平均相对分子质量不随时间而变化 | B.υ正(H2O)=υ逆(H2) |
| C.容器中气体的密度不随时间而变化 | D.容器中总的物质的量不随时间而变化 |

一定温度下在体积为5 L的密闭容器中发生可逆反应。
(Ⅰ)若某可逆反应的化学平衡常数表达式为:

(1)写出该反应的化学方程式: ;
(2)能判断该反应一定达到化学平衡状态的依据是 (填选项编号)。
A. 容器中气体的平均相对分子质量不随时间而变化 B. υ正(H2O)=υ逆(H2)
C. 容器中气体的密度不随时间而变化 D. 容器中总的物质的量不随时间而变化
E. 消耗n mol H2的同时消耗n mol CO
(Ⅱ)某高温下,若该5 L密闭容器中加入的是2molFe(s)与1.00mol H2O(g),t1秒时,H2的物质的量为0.20 mol,到第t2秒时恰好达到平衡,此时H2的物质的量为0.50mol 。
(1) t1~t2这段时间内的化学反应速率v(H2)= 。
(2)计算该可逆反应t2达到平衡时的K值。(要求写出计算过程)
(3)该反应的逆反应速率随时间变化的关系如右图。t1时改变了某种条件,改变的条件可能是 、 。(填写2项)

湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com