
题目列表(包括答案和解析)
(2011·上海十四校联考)甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙。则下列叙述正确的是( )

A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲、乙中溶液的pH逐渐升高,丙中溶液的pH逐渐减小
(2011·上海十四校联考)甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙。则下列叙述正确的是( )
A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同
D.甲、乙中溶液的pH逐渐升高,丙中溶液的pH逐渐减小
(08上海嘉定区期末)某化学课外兴趣小组探究铜与浓硫酸的反应情况。甲、乙、丙三位同学进行了下列实验:取12.8g铜片和20ml、18mol/L的浓硫酸放在圆底烧瓶中共热,直至反应完毕,最后发现烧瓶中还有铜片剩余外,同时根据所学的知识认为还有较多的硫酸剩余。(1)请写出铜跟浓硫酸反应的化学方程式:______________________________
试问:为什么较多的余酸不再与铜片继续反应?简述理由:_______________________________________________________________。
可以证明有余酸的实验方案是________(填写字母,错选或多选扣分)
(a)再加入铁粉 (b)再滴入BaCl2溶液 (c)再加入银粉(d)再滴入Na2CO3溶液
(2)甲学生设计求余酸浓度的实验方案是测定产生气体的量。其方法有多种,请问下列方案中不可行的是________(填写字母,错选或多选扣分)
(a)将产生的气体缓缓通过预先称量盛有碱石灰的干燥管,结束反应后再次称量。
(b)将产生的气体缓缓通入酸性高锰酸钾溶液,再加入足量BaCl2溶液,过滤、洗涤、干燥、称量沉淀。
(c)用排水法测定其产生气体的体积(折算成标准状况)。
(d)用排饱和NaHSO3溶液的方法测出其产生气体的体积(折算成标准状况)。
(3)乙同学设计测定余酸浓度的实验方案是:测定反应后的混合液中Cu2+的量。在反应后的溶液中加蒸馏水稀释至100ml,加入足量Na2S溶液,充分反应后,过滤、洗涤、干燥、称量沉淀。请写出生成沉淀的离子方程式:___________________________________
(4)根据甲、乙两同学的实验方案,除测算产生气体的物质的量或反应掉的铜的物质的量外,尚缺少的测量数据是_________________________________。
(5)丙同学提出甲、乙两同学的实验方案设计的复杂,为此他设计了下列较为简易的实验方案:取出反应后的铜片,进行洗涤、干燥、称量。若称得剩余铜片的质量为Wg,测得
反应后溶液的体积为Vml,请计算剩余硫酸的物质的量浓度
=______________________mol/L(用含W、V的代数式表示)
(2011·上海十四校联考)甲、乙、丙三个烧杯中分别装有稀硫酸、氯化铜溶液、饱和食盐水,把用导线连接的锌片和铜片插入甲,把分别与直流电源正、负极相连的C1、C2插入乙,把分别与直流电源正、负极相连的C3、铁片插入丙。则下列叙述正确的是( )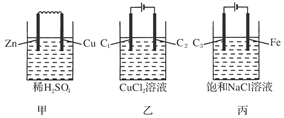
| A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能 |
| B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应 |
| C.C1和C3放出的气体相同,铜片和铁片放出的气体也相同 |
| D.甲、乙中溶液的pH逐渐升高,丙中溶液的pH逐渐减小 |
(08上海建平中学期末)元素周期表反映了元素性质的周期性变化规律。请根据短周期元素在周期表中的位置、结构和相关性质,回答下列问题:

(1)短周期元素中,原子最外层电子数和电子层数相等的元素有 种。
(2)第二周期元素中,除Be、B、Ne三种元素外,其他元素的氢化物沸点如下表1所示,其中C的化学式为 ;第三周期元素单质的熔点(℃)变化如下图I所示,其中h的元素符号为 。
(3)原子半径最小的元素与第二周期的两种元素可分别形成分子甲和离子乙。分子甲和离子乙含有相等的电子数,且乙的立体结构如图II所示。请写出甲、乙反应的离子方程式
。
(4)第二、第三周期的某些元素中能形成具有图II所示的结构单元的单质丙和化合物丁,丙和丁的晶体类型相同,且丙与丁在高温时能发生置换反应。若该反应中丙被破坏了1 mol共价键,则参加反应的丁的质量为 g。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com