
题目列表(包括答案和解析)
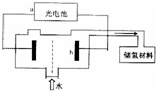 氢气是中学化学中常见的气体之一,它是一中新型的绿色能源,又是一种重要的化工原料.
氢气是中学化学中常见的气体之一,它是一中新型的绿色能源,又是一种重要的化工原料.
| ||
| ||
在中学化学实验室中,可通过下图的方法制得一种常见的有毒气体![]() 。
。
![]() 是黑色粉末,
是黑色粉末,![]() 是白色固体(焰色反应透过蓝色钴玻璃呈紫色,可用于制备火柴),且都是常见的氧化剂。
是白色固体(焰色反应透过蓝色钴玻璃呈紫色,可用于制备火柴),且都是常见的氧化剂。
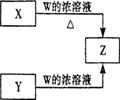
(1)写出![]() 与W的浓溶液共热生成
与W的浓溶液共热生成![]() 的离子方程式 。
的离子方程式 。
(2) ![]() 与
与![]() 混合后共热可产生一种无毒气体,反应的化学方程式为 。
混合后共热可产生一种无毒气体,反应的化学方程式为 。
下图是实验室常见的气体发生装置,此反应应选用的发生装置是 (填字母编号)。实验过程中,检验气密性之后(气密性良好),向该装置中加入粉末状固体的操作是: 。

 (3)
(3) ![]() 与乙烯加成可得一种有机物,为验证该有机物中含有与
与乙烯加成可得一种有机物,为验证该有机物中含有与![]() 相同的元素,请选择合适的试剂 (用字母编号回答)。
相同的元素,请选择合适的试剂 (用字母编号回答)。
a.稀盐酸 b.稀硝酸 c.稀硫酸 d.氢氧化钠溶液
e.硝酸银溶液 f.淀粉溶液 g.碘化钾溶液 h.品红溶液
(4)在实验室中制取气体![]() 时,通常可用排某种溶液的方法收集
时,通常可用排某种溶液的方法收集![]() ,则该溶液是 ;也可用排空气集气法收集
,则该溶液是 ;也可用排空气集气法收集![]() ,若用右图装置(不能改变瓶口朝向),则气体应该从 (填“m”或“n”)口进。
,若用右图装置(不能改变瓶口朝向),则气体应该从 (填“m”或“n”)口进。
(5)有人设想利用原电池原理以![]() 和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入
和氢气制备一种重要的化工原料,同时获取电能。假设这种想法可行,用石墨作电极材料,用稀盐酸作电解质溶液,则通入![]() 的电极为原电池的 极,其电极反应式为 。
的电极为原电池的 极,其电极反应式为 。
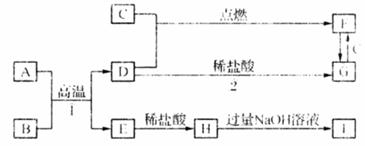
下图是中学化学一些常见元素的单质及化合物的转化关系,已知:A是金属单质,B是淡黄色固体,G是无色气体,I是红棕色气体,反应②是工业上重要反应。请按要求完成下列各题内容:

(1)写出B的电子式:___________________;D的结构式是__________________。
(2)反应③的实验现象为________________________________________________。
(3)反应①的离子方程式为_______________________________________________。
(4)反应②的化学方程式为________________________________________________。
下图是中学化学常见物质之间的转化关系图,有些反应中的部分物质被略去。在通常情况下,A为红棕色粉末,C是一种黄绿色气体,B、D均为金属。其中反应①在工业上有重要应用。
淆回答下列问题:
(1)C的电子式为 。 (2)I的化学式为 。
(3)反应①的化学方程式为 。
(4)反应②的离子方程式为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com