
题目列表(包括答案和解析)
平衡是化学反应原理中的重要内容。按要求回答下列问题:
(1)已知:2SO2(g)+O2(g) 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1
2NO(g)+O2(g) 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2
则反应NO2(g)+SO2(g) SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
(2)已知A(g)+B(g)  C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。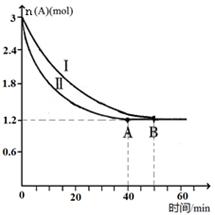
①实验Ⅱ可能改变的条件是_______________。
②T1℃时该反应的平衡常数为_____(用分数表 示),达到平衡时,A的反应速率为____。
(3)已知HCN溶液的电离平衡常数Ka=10-5mol?L-1,c平衡(HCN)≈c起始(HCN),水的电离可不计,则此温度下0.1 mol?L-1的HCN溶液的pH=_________。
(4)对于0.1mol?L-1 Na2CO3溶液,该溶液中离子浓度由大到小的顺序是______,向该溶液中加水稀释的过程中,c(H2CO3)逐渐____(填“增大”“不变”或“减小”, 下同) ,c(H2CO3)/ c(CO32-)逐渐______。
 2SO3(g) ΔH1 平衡常数为K1
2SO3(g) ΔH1 平衡常数为K1 2NO2(g) ΔH2 平衡常数为K2
2NO2(g) ΔH2 平衡常数为K2 SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。
SO3(g)+NO(g)的ΔH="______" (用ΔH 1和ΔH 2表示);此反应该温度下的平衡常数K=______(用K1和K2表示)。 C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。
C(g)+D(g),该反应在3L密闭容器中,在两种不同的条件下进行反应,A、B的起始物质的是分别为3.0mol和6.0mol,其中实验I的条件为T1℃。A的物质的量随时间的变化如图所示。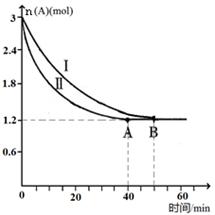
(14分) 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:?
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH(g)+1/2O
(g)=CO(g)+2H
(g)
H1=-35.6kJ·mol
试判断常温下,上述反应能否自发进行: (填”能”或”否”)。有研究认为甲烷部分氧化的机理为:
②CH(g)+2O
(g)=CO2(g)+2H2O(g)
H2=-890.3kJ·mol
③CH(g)+CO
(g)=2CO(g)+2H
(g)
H3=247.3kJ·mol
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:
。
⑵恒温下,向一个2L的密闭容器中充入1molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
实验数据
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为 。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。?
①b处电极上发生的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH (填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu的物质的量浓度 。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷 L (标准状况下)。
(14分) 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:?
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH (g)+1/2O
(g)+1/2O (g)=CO(g)+2H
(g)=CO(g)+2H (g)
(g)  H1=-35.6kJ·mol
H1=-35.6kJ·mol
试判断常温下,上述反应能否自发进行: (填”能”或”否”)。有研究认为甲烷部分氧化的机理为:
②CH (g)+2O
(g)+2O (g)=CO2(g)+2H2O(g)
(g)=CO2(g)+2H2O(g)  H2=-890.3kJ·mol
H2=-890.3kJ·mol
③CH (g)+CO
(g)+CO (g)=2CO(g)+2H
(g)=2CO(g)+2H (g)
(g)  H3=247.3kJ·mol
H3=247.3kJ·mol
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:
。
⑵恒温下,向一个2L的密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
实验数据
| 时间/min | 5 | 10 | 15 | 20 | 25 | 30 |
| c(NH3)/( mol ·/L-1) | 0.08 | 0.14 | 0.18 | 0.20 | 0.20 | 0.20 |

 的物质的量浓度 。
的物质的量浓度 。(14分) 甲烷作为一种新能源在化学领域应用广泛,请回答下列问题:?
(1)以天然气为原料制H2是合成氨的一条重要的路线。甲烷的部分氧化可得到合成氨的原料气H2,其反应式如下:
①CH (g)+1/2O
(g)+1/2O (g)=CO(g)+2H
(g)=CO(g)+2H (g)
(g)  H1=-35.6kJ·mol
H1=-35.6kJ·mol
试判断常温下,上述反应能否自发进行: (填”能”或”否”)。有研究认为甲烷部分氧化的机理为:
②CH (g)+2O
(g)+2O (g)=CO2(g)+2H2O(g)
(g)=CO2(g)+2H2O(g)  H2=-890.3kJ·mol
H2=-890.3kJ·mol
③CH (g)+CO
(g)+CO (g)=2CO(g)+2H
(g)=2CO(g)+2H (g)
(g)  H3=247.3kJ·mol
H3=247.3kJ·mol
请结合以上条件写出CH4和H2O(g)生成CO和H2的热化学反应方程式:
。
⑵恒温下,向一个2L的密闭容器中充入1 molN2和2.6 molH2,反应过程中对NH3的浓度进行检测,得到的数据如下表所示:
实验数据
|
时间/min |
5 |
10 |
15 |
20 |
25 |
30 |
|
c(NH3)/( mol ·/L-1) |
0.08 |
0.14 |
0.18 |
0.20 |
0.20 |
0.20 |
此条件下,该反应达到化学平衡时,氮气的浓度为 。
(3)如下图所示,装置Ⅰ为甲烷燃料电池(电解质溶液为KOH溶液),通过装置Ⅱ实现铁棒上镀铜。?

①b处电极上发生的电极反应式是 。
②电镀结束后,装置Ⅰ中溶液的pH
(填写“变大”、“变小”或“不变”,下同),装置Ⅱ中Cu 的物质的量浓度
。
的物质的量浓度
。
③若完全反应后,装置Ⅱ中阴极质量增加12.8g,则装置Ⅰ中理论上消耗甲烷 L (标准状况下)。
2008.10
一、选择题(1---10题每空2分,11―20题每空3分;共50分)
1
2
3
4
5
6
7
8
9
10
B
A
A
D
C
B
B
A
D
C
11
12
13
14
15
16
17
18
19
20
B
D
A
A
B
D
D
A
C
C
二.填空题 (21题9分,22题9分。共18分)
21. (每空3分,共9分)
(1)N2H4(l)+2H2O2(l)=N2(g) +4H2O(g) △H=-644.25 KJ/mol
(2)410.125
(3)产物不会造成环境污染。
22. (每空2-3分 共9分)
(1) ;(3分)
;(3分)
(2)吸热; (2分)
(3)b、c; (2分)
(4)830 (2分)
三.实验题和推断题(23题12 分,24题 9分, 共21分)
23.(每问2分,共12分)
(1)环形玻璃搅拌棒 (2分)
(2)减少实验过程中的热量损失 (2分)
(3)偏小 (2分)
(4)不相等;相等; (4分)
(5)偏小 (2分)
24.(每空3分 共9分)
(1)2Al + 6H+ = 2Al3+ + 3H2↑ (3分)
(2)反应放出热量,温度升高,使化学反应速率加快(3分)
(3)(说明:可能存在多种假设,但只要假设合理均可)Cl-能够促进金属铝与H+反应;SO42- 对H+与金属铝的反应起阻碍作用。(3分)
【解析】氢离子浓度和铝片均相同,造成的差异应该与反应
(即2Al + 6H+ = 2Al3+ + 3H2↑)所处环境的不同(Cl- 和SO42-)有关。
四.计算题 (12分)
25.(每空2分,共6分)
2mol/(L?min);
1mol/(L?min);
2mol/L
26.(6分)
⑴x=4
⑵ >
⑶ C
(第四问选做)
(每空3分,共6分)
(4) a/4;
2.4+
(解析)
由已知得 消耗B=0.2mol 生成C 0.4mol/L*
所以x=4
由于此反应方程式前后系数和相等,则压强变化对平衡不起作用,所以只需把所有物质化到一边,使物质的量成比例即可。原平衡前为A:B=3:2,题中加入amolC,就是
原平衡时A,B,C的摩尔比为2.4:1.8:0.8,新平衡也满足这个比例
x/(a-4x/3)=3 所以x=
所以n(A)=(2.4+
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com